Главная / Статьи / Кардиология
Хроническая сердечная недостаточность в старшем возрасте: акцент на коррекцию метаболического ремоделирования.
Горохова Светлана Георгиевна, доктор медицинских наук, профессор.
Московская медицинская академия им. И.М.Сеченова Росдрава, Москва.
Хроническая сердечная недостаточность (ХСН) – заболевание с высокой распространенностью в старших возрастных группах – развивается в результате постепенного снижения функции сердца при нормальном старении, возрастзависимой патологии, прогрессирующих болезней сердца на определенном этапе сердечно-сосудистого континуума. Изменения в сердце при старении и ХСН проявляются не только структурным, но и метаболическим ремоделированием, что требует применения иных лечебных подходов. Стратегия коррекции метаболического ремоделирования предполагает использование лекарств, обладающих направленным действием на нарушения в энергообмене, свободнорадикальное окисление жирных кислот (метаболические препараты и антиоксиданты, включая триметазидин, коэнзим Q10) совместно с базисными средствами (ингибиторы АПФ, бета-блокаторы и др.). Рассмотрены вопросы многоцелевой монотерапии у пожилых с ХСН и возрастзависимыми изменениями в других органах.
Publication title: Chronic heart failure in elderly: emphasis on the metabolic remodelling correction.
Author (first name, surname and academic degree): Svetlana Gorokhova, MD, PhD, professor.
Name of institution, city: I.M. Sechenov Moscow Medical Academy under The Federal Agency of Health Care and Social Development, Moscow, Russia.
Chronic heart failure (CHF) is highly prevalent among older age groups. The disease develops due to decreasing of heart function during normal aging process, age-related pathology and progressive heart diseases on certain stage of the cardiovascular continuum. CHF and age-related heart disorders are characterised by structural as well as metabolic changes, so different therapeutic strategies should be applied. The strategy based on the metabolic changes correction includes delivering drugs designed for energy exchange and free-radical fatty acid oxidation correction (metabolic drugs and anti-oxidants, including trimetazidine, coenzyme Q10) along with basic drugs (ACE inhibitors, beta-blockers etc.). Some practical issues of CHF treatment and multi-directional monotherapy in elderly are discussed in this article.
Хроническая сердечная недостаточность в старшем возрасте: акцент на коррекцию метаболического ремоделирования
С.Г. Горохова, профессор, доктор медицинских наук
Московская медицинская академия им. И.М. Сеченова
Реальность нашего времени - увеличение числа больных с хронической сердечной недостаточностью (ХСН), возраст которых превышает 60 лет. В различных странах мира средний возраст пациентов с ХСН - 74-76 лет. Средняя заболеваемость составляет среди 55-64-летних - 3,0-4,0, 75-84-летних - 13,0-14,0 населения и среди лиц старше 85 лет - 11,6 на 1000. По данным Cardiovascular Health Study, в возрасте 66 – 103 лет частота выявления новых случаев симптоматической ХСН составляет у 65–69-летних - 10,6, старше 80 лет - 42,5 на 1000 населения в год.
Согласно концепции формирования заболеваний в старшем возрасте, ХСН может развиваться в результате: а) постепенного снижения функции сердца при нормальном старении, б) возрастзависимой патологии (например, сенильный амилоидоз), в) прогрессирующей сердечно-сосудистой патологии на определенном этапе сердечно-сосудистого континуума.
Изучение ХСН в пожилом и старческом возрасте показывает ряд особенностей патофизиологии заболевания и тактики лечения больных, что связано с характерными для сердца стареющего человека изменениями. Так, в стареющих кардиомиоцитах выявляется редукция теломер — монотонно повторяющихся некодирующих последовательностей ДНК, расположенных на концах хромосом и защищающих их от укорочения. С укорочением теломер связывают такие возрастассоциированные изменения как накопление оксидативных повреждений в миокарде, апоптоз кардиомиоцитов. Свободные радикалы (молекулы супеpоксида О2-, Н2О2, гидpоксильного pадикала НО- и, возможно, синглетного кислорода) могут повреждать макpомолекулы мембран, коллагена, ДНК, хроматина, структурных белков, а также участвуют в эпигенетической регуляции экспрессии ядерных и митохондриальных генов, влияют на внутриклеточный уровень кальция и т.д. По данным ряда исследований, в стареющем сердце выявляются множественные нарушения активности миофиламентов, механизмов возбуждения и сокращения, дисрегуляция Ca2+, дефицит сигнала потенциала действия и повреждения экспрессии гена белков, обеспечивающих процесс сокращение – расслабление. Апоптоз клеток, который активизируется в связи с усилением чувствительности клеток к апоптотическим стимулам при старении, приводит к потере кардиомиоцитов, замещению клеточной массы соединительной тканью, прогрессирующему в интерстициальный фиброз миокарда. Это, в свою очередь, способствует повышению нагрузки на сохранившиеся кардиомиоциты, гипертрофии левого желудочка, которая в такой ситуации является проявлением адаптивного ремоделирования сердца.
Возрастзависимые изменения развиваются при нормальном старении постепенно, и скорость их такова, что возможна ко-адаптация внутренней среды организма, и, не-смотря на происходящие изменения, стареющий миокард остается жизнеспособным. Однако он становится более уязвимым. При небольших дополнительных нагрузках, пре-вышающих предел адаптации, нарушения усугубляются, в результате чего функция сердца снижается, и развивается ХСН, проявляющаяся систолической или, чаще, диастолической дисфункцией левого желудочка. В реальной жизни, когда сценарий нормального старения реализуется довольно редко, одновременно с возрастзависимыми процессами в сердце происходят специфические нарушения структуры и функции сердца, отражающие ту или иную болезнь (например, постинфарктная аневризма левого желудочка), что усиливает ремоделирование. В таких случаях на молекулярно-клеточном уровне происходит не простая суммация, а переплетение изменений и смещение акцентов в ходе патологических процессов.
Принципиально важно, что ремоделирование сердца при старении и ХСН происходит не только на уровне структуры. Структурные изменения сердца реципрокно связаны с метаболизмом в миокарде. В экспериментальных и клинических исследованиях показано, что гипертрофия миокарда характеризуется изменениями в энергообмене в кардиомиоцитах: нарушения в утилизации субстрата, процессах окислительного фосфорилирования и метаболизме макроэргических фосфатов со сдвигом в сторону окисления глюкозы. Продолжительное существование сдвигов в субстрате и энергетическом метаболизме предложено называть метаболическим ремоделированием.
Молекулярные и генетические механизмы, вызывающие метаболическое ремоделирование, не до конца изучены. Тем не менее, полученные на сегодня данные показывают близость выявляемых метаболических нарушений при старении и при ХСН, возникающей при распространенных сердечно-сосудистых заболеваниях (ИБС, артериальной гипертензии). Наблюдаемые в миокарде дисфункция митохондрий и нарушения в выработке ATФ, утилизации субстрата ассоциированы со снижением захвата и окисления жирных кислот, образованием свободных радикалов (в том числе, супероксида), усугубляющих повреждения в клетке, разобщением процессов доставки и потребления кислорода, усилением гликолиза и другими процессами. Причем переключения метаболизма на повышение окисления глюкозы может быть недостаточно, чтобы компенсировать энергодефицит. К тому же, по мере прогрессирования ХСН нарушается утилизация глюкозы, и кардиомиоциты приобретают резистентность к инсулину.
Итак, нарушения в сердце при старении и ХСН проявляются не только структур-ным, но и метаболическим ремоделированием. Поскольку разработка стратегии лечения ХСН всегда имеет в виду патогенетическую концепцию заболевания (рис. 1), то зададимся вопросом о том, насколько существующие лекарства, из числа сегодня назначаемых больным с ХСН, могут корректировать эти изменения.
Фармакотерапия ХСН подразумевает использование комплекса лекарств разных фармакотерапевтических групп. При этом выделяют основные (базовые), допол-нительные и вспомогательные (адъювантные) лекарственные средства. Список препаратов в каждой из этих групп постоянно пополняется. Обязательное требование к ним: все лекарства должны быть достаточно изучены в клинических исследованиях.
В группу базовых средств входят лекарства, воздействующие на основные звенья патогенеза ХСН, то есть осуществляющие нейрогормональную модуляцию, дегидратацию, положительную инотропную стимуляцию сердца, а также периферическую вазодилатацию. Это хорошо известные ингибиторы АПФ, диуретики и b–адреноблокаторы, сердечные гликозиды, антагонисты АТ1 рецепторов. У лиц пожилого и старческого возраста отмечают их хорошую переносимость. Коррекция дозы нужна при сопутствующей почечной недостаточности; сердечные гликозиды назначают в меньших (половинных) дозах из-за большей вероятности возникновения гликозидной интоксикации.
К дополнительным средствам относят те лекарства, которые, обладая собственными фармакологическими эффектами, оказывают добавочное действие, направленное на коррекцию симптомов ХСН и состояний, способствующих прогрессированию ХСН. К ним относят антиаритмики, антиагреганты, препараты для лечения анемии и др.
Адъювантные средства - лекарства, эффективность которых обусловлена их собственным действием на патогенетические механизмы и способностью увеличивать эффективность других лекарств, улучшать общие результаты лечения. В первую очередь, это ряд метаболических средств, антиоксиданты.
С точки зрения оценки влияния лекарств на ремоделирование сердца, наиболее изучены базовые препараты. Убедительно доказано их положительное действие на все составляющие структурного ремоделирования сердца, включая гипертрофию миокарда и дилатацию полостей сердца, показатели систолической и диастолической функции. Однако на метаболизм миокарда они оказывают опосредованное влияние. Также не стоит ожидать прямого воздействия на энергообмен в миокарде от лекарств, входящих в группу дополнительных. В отличие от них некоторые адъювантные средства действуют на энергетический метаболизм целенаправленно.
Эффективность использования метаболических средств при ХСН хорошо известна большинству врачей терапевтов и кардиологов из опыта практической работы. Так, достаточно давно, с 1960-х годов, многим больным назначают глюкозо–инсулино–калиевую смесь, которую часто называют «поляризующей» (в этом названии фамилия D. Sodi–Pallaris, впервые продемонстрировавшего положительный результат ее применения при инфаркте миокарда, слилась с предложенным им методом электролитной поляризационной терапии). Данная смесь модулирует метаболизм миокарда, способствуя оптимизации захвата и окисления глюкозы, снижению уровня свободных жирных кислот, быстрому увеличению уровня внутриклеточного калия. В таких условиях можно предполагать более полное фармакологическое действие основных препаратов для лечения ХСН.
Другим метаболическим средством является триметазидин – миокардиальный цитопротектор, представляющий ингибитор митохондриальной длинноцепочечной 3–кетоацил-КоА-тиолазы. Его действие направлено на нормализацию энергетического метаболизма клеток путем оптимизации использования кислорода миокардом в условиях ишемии за счет усиления аэробного гликолиза и уменьшения интенсивности окисления жирных кислот. Под влиянием триметазидина в кардиомиоцитах предотвращается снижение внутриклеточного содержания АТФ, уменьшается внутриклеточный ацидоз и накопление ионов Na+ и Са2+, происходит улучшение процессов окислительного фосфорилирования с уменьшением продукции митохондриями свободных радикалов. Хотя прямого влияния на гемодинамику и сократимость миокарда триметазидин не оказывает, у больных при его приеме отмечаются положительная динамика размеров левого желудочка, систолической функции левого желудочка, что связано с улучшением состояния ишемизированных кардиомиоцитов. Назначение триметазидина целесообразно при ишемической ХСН, при гибернированном миокарде, сахарном диабете. Учитывают, что под влиянием триметазидина достоверно уменьшается частота ангинозных приступов, повышается толерантность к физической нагрузке, нет резких колебаний АД, влияния на ЧСС. Продолжительность терапии устанавливают индивидуально в зависимости от клинической ситуации. Возможно длительное лечение препаратом, в течение 6 месяцев и больше, наряду с обычной терапией.
Большое значение придают лекарству с другим механизмом действия - убихинону, или коэнзиму Q10 (КоQ10), который играет ключевую роль в митохондриальном окислительном фосфорилировании и синтезе АТФ и в восстановленной форме (убихинол) обладает свойствами мощного антиоксиданта: ингибирует процессы перекисного окисления липидов биомембран и липопротеидов циркулирующей крови, окисление ДНК и белков в результате, главным образом, взаимодействия со свободными радикалами, регулирует физико-химические свойства мембран. Показано влияние КоQ10 на экспрессию генов, связанных с клеточным метаболизмом, передачей сигналов от клетки к клетке. Он модулирует количество β-интегринов на поверхности моноцитов крови, эндотелиальную функцию, в связи с чем его применяют для терапии и профилактики артериальной гипертензии, атеросклероза. При ХСН КоQ10 взаимодействует с супероксид анионом и снижает его уровень.
Содержание КоQ10 наибольшее в кардиомиоцитах. Однако при нормальном старении биосинтез КоQ10 и во всем организме, и в сердце постепенно снижается. При ХСН уровень КоQ10 в тканях уменьшается значительно. Предполагают связь плохого прогноза у больных ХСН с низкой концентрацией убихинона в миокарде и плазме крови (уровень КоQ10 в плазме крови, в целом, отражает его содержание в тканях). Так, в опубликованном в 2008 году проспективном исследовании выживаемости больных с ХСН (средний возраст - 77 лет) S.L.Molyneux и соавт. показали, что уровень КоQ10 в плазме - независимый предиктор смертности в этой когорте наряду с перенесенным инфарктом, BNP, клубочковой фильтрацией, полом и возрастом.
Следует заметить, что КоQ10 был введен в клиническую практику как средство для лечения именно ХСН сначала при дилатационной кардиомиопатии, а затем у больных с ХСН ишемического генеза. Позднее в систематическом обзоре S.Sander и мета-анализе S.A.Mortensen сделан вывод о положительном влиянии КоQ10 на систолическую функцию сердца при ХСН вне зависимости от этиологии. В то же время абсолютный прирост фракции выброса левого желудочка зависит от функционального класса ХСН, категории больных. Добавление КоQ10 к общепринятой терапии при кардиомиопатии и ХСН ФК I позволяет увеличить фракцию выброса с 17% до 59%, при тяжелой и длительной ХСН – в среднем на 3,7-6,7%. При этом влияние КоQ10 на миокард проявляется отчетливой положительной динамикой клинических симптомов (одышки, отеков, ощущения аритмии и пр.), ФК ХСН по NYHA, толерантности к физической нагрузке, качества жизни пациентов.
С практической точки зрения, важно, когда следует ожидать эффект от применения адъювантных средств. Как показывает опыт, его трудно оценить в первые дни приема препаратов. Так, при применении КоQ10 (препарат Кудесан - водорастворимая форма КоQ10 с улучшенной биодоступностью, в суточной дозе 50-150 мг) отмеченные выше терапевтические эффекты заметны через 1 месяц и отчётливы к 3 месяцу приема. По данным Д.А. Аронова, максимум эффекта данного препарата ожидают при сроке лечения от 6 месяцев. После отмены он сохраняется в течение 1 месяца или более, что подсказывает необходимость повторных курсов лечения.
Было бы неверным считать вышеназванные лекарства дублирующими друг друга или взаимоисключающими. ГИК дает субстрат, триметазидин - усиливает окисление глюкозы и уменьшает активность окисления жирных кислот, КоQ10 взаимодействуeт со свободными радикалами, усиливает синтез АТФ в клетках, а также оказывает влияние на экспрессию генов, связанных с клеточным метаболизмом (табл. 1). Взаимодействие с генетическими факторами, осуществляющими контроль энергообмена, оценивают как весьма существенное и мощное фармакологическое направление.
В настоящее время изучают эффективность при ХСН других лекарств, влияющих на метаболизм миокарда, среди которых ранолазин, аденозин трифосфат, L-карнитин, пергексилин, этомоксир и т.д. Однако данных в отношении их эффективности у пожилых с ХСН пока недостаточно, и необходимы дальнейшие клинические исследования.
Подчеркнем, что в фармакологии адъвантные лекарства рекомендуют принимать совместно с базовыми. КоQ10 часто включают в комплекс терапии ХСН, причем некоторые больные применяют его самостоятельно, исходя из собственной оценки положительного влияния на самочувствие. Это объяснимо тем, что КоQ10 не входит в перечни лекарственных средств для льготного отпуска и др., хотя он жизненно необходим при заболеваниях с врожденным или приобретенным дефицитом КоQ10, при митохондриальной кардиомиопатии. Заметим, что применение коэнзима Q10 при ХСН одобрено некоторыми национальными правительственными комитетами (например, в Японии).
Важная особенность ХСН у больных старшего возраста - её возникновение и течение при одновременном существовании других заболеваний, или полиморбидность. Определено, что в старшем возрасте при ХСН закономерно выявляют когнитивные нарушения, старческий или медикаментозно индуцированный паркинсонизм, нейродегенеративная патология, заболевания желудочно-кишечного тракта, сахарный диабет, тугоухость, снижение зрения и т.д.
В связи с этим следует вновь обратиться к КоQ10 как лекарству, применение которого изучалось при нейродегенеративных заболеваниях. В ряде экспериментальных и клинических исследований выявлено нейропротективное действие КоQ10, возмож-ности улучшения когнитивных функций при болезни Паркинсона, болезни Альцгеймера, в том числе связанной с амилоидозом. Кроме того, обсуждают применение КоQ10 при нейросенсорной тугоухости, так как отмечено снижение его содержания в плазме и одновременно повышенный сердечно-сосудистый риск у больных с этой патологией. Учитывая эти факты, можно говорить, о применении КоQ10 в старшем возрасте как отвечающем принципу многоцелевой монотерапии.
Подводя итог сказанному, выделим следующие моменты.
Медикаментозная терапия ХСН в старшем возрасте включает назначение комплекса лекарств, действующих на разные патогенетические механизмы, приводящие к структурному и метаболическому ремоделированию сердца.
Стратегию коррекции метаболического ремоделирования рассматривают как важную составляющую общего плана лекарственной терапии у пожилых. При этом адъювантные лекарственные средства (метаболические препараты и антиоксиданты), действие которых направлено на коррекцию нарушений в энергообмене, свободнорадикальное окисление жирных кислот, нельзя считать альтернативными. Их применяют совместно с базисными (ингибиторы АПФ, бета-блокаторы и др.), назначаемыми преимущественно с целью коррекции структурно-функциональных нарушений и устранения симптомов ХСН.
При выборе лекарств следует учитывать принцип многоцелевой монотерапии и целенаправленно использовать лекарства, которые способны одновременно воздействовать на метаболическое ремоделирование и уменьшать развитие возрастзависимых изменений в сердце и других органах.
- Анисимов В.Н. Молекулярные и физиологические механизмы старения. СПб., Наука, 2003.
- Аронов Д.М. Применение коэнзима Q10 в кардиологической практике. РМЖ. 2004, Т 12, №15, 905–909.
- Горохова С.Г. Сердечно-сосудистые заболевания в старших возрастных группах. // Кардиология. Национальное руководство для врачей. Под ред. Ю.Н. Беленкова, Р.Г. Оганова - М., 2007.
- Капелько В.И. Активные формы кислорода, антиоксиданты и профилактика заболеваний сердца. РМЖ. 2003, Т.11, № 21, 1185–1188.
- Капелько В.И. Рууге Э.К. Исследование действия коэнзима Q10 (Убихинона) при ишемии и реперфузии сердца. Применение антиоксидантного препарата кудесан (коэнзим Q10 с витамином Е) в кардиологии. Москва. 2002.
- Лакомкин В.Л., Коркина О.В. и соавт. Защитное действие убихинона (коэнзим Q10) при ишемии и реперфузии сердца. Кардиология. 2002, 12, 51–55.
- Ланкин В.З., Тихазе А.К., Беленков Ю.Н. Антиоксиданты в комплексной терапии атеросклероза: pro et contra. Кардиология 2004, 2, 72–81.
- Ланкин В.З., Тихазе А.К., Беленков Ю.Н. Свободнорадикальные процессы при заболевании сердечно–сосудистой системы. Кардиология. 2000, 40 (7), 48–61.
- Рибера-Кассадо Дж.М. Старение и сердечно-сосудистая система // Клин. геронтология. - 2000. - №. 11-12. – C.28-36.
- Шилов А.М. Антигипоксанты и антиоксиданты в кардиологической практике.
- Aalami O.O., Fang T.D., Song H.M., Nacamuli R.P. Physiological Features of Aging Persons Arch Surg. 2003;138:1068-1076
- Aeby A., Sznajer Y., Cavé H. et al. Cardiofaciocutaneous (CFC) syndrome associated with muscular coenzyme Q10 deficiency. J Inherit Metab Dis. 2007;30(5):827.
- Baggio E., Gandini R., Plancher A.C. et al. Italian multicenter study on the safety and efficacy of coenzyme Q10 as adjunctive therapy in heart failure. Mol Aspects Med, 1994;15s:287–294.
- Belardinelli R., Muçaj A., Lacalaprice F. et al. Coenzyme Q10 improves contractility of dysfunctional myocardium in chronic heart failure. Biofactors. 2005; 25(1-4):137-45.
- Belardinelli1 R., Muçaj A., Lacalaprice F. et al. Biochemical functions of coenzyme Q10. J Am Coll Nutr. 2001;20:591-598.
- Bernhard D., Laufer G. The Aging Cardiomyocyte: A Mini-Review Gerontology 2008;54:24–31
- Braunwald E. Congestive heart failure: a half century perspective // Europ. Heart J. - 2001. – Vol.22. – P. 825-836.
- Cadoni G., Scipione S., Agostino S. et al. Coenzyme Q 10 and cardiovascular risk factors in idiopathic sudden sensorineural hearing loss patients. Otol Neurotol. 2007; 28 (7) : 878-83.
- Fannin S.W., Lesnefsky E.J., Slabe T.J. et al. Aging selectively decreases oxidative capacity in rat heart interfibrillar mitochondria. Arch Biochem Biophys. 1999; 372 (2): 399–407,
- Fragasso G., Salerno A., Spoladore R. et al. Metabolic therapy of heart failure. Curr Pharm Des. 2008;14(25):2582-91.
- Gottdiener J.S., Arnold A.M., Aurigemma G.P. et al. Predictors of congestive heart failure in the elderly: the Cardiovascular Health Study. J Am Coll Cardiol. 2000; 35: 1628-1637.
- Haas R.H. The evidence basis for coenzyme Q therapy in oxidative phosphorylation disease. Mitochondrion. 2007;7 Suppl:S136-45.
- Hagen T.M., Moreau R., Suh J.H., Visioli F. Mitochondrial decay in the aging rat heart: evidence for improvement by dietary supplementation with acetyl-L-carnitine and/or lipoic acid. Ann NY Acad Sci. 2002; 959:491-507.
- Hansford R.G., Castro F. Age-linked changes in the activity of enzymes of the tricarboxylate cycle and lipid oxidation, and of carnitine content, in muscles of the rat. Mech Ageing Dev 1982; 19: 191–200,.
- Hofman-Bang C., Rehnqvist N., Swedberg K. et al. Coenzyme Q10 as an adjunctive in the treatment of chronic congestive heart failure. The Q10 Study Group. J Card Fail. 1995;1:101-7.
- Hsu P.C., Chu C.S., Lin T.H. et al. Adult-onset hypertrophic cardiomyopathy manifested as initial major presentation of mitochondrial disease with A-to-G 3243 tRNA (Leu(UUR)) point mutation. Int J Cardiol. 2007; 10.
- Khatta M., Alexander B.S., Krichten C.M. et al. The Effect of Coenzyme Q10 in Patients with Congestive Heart Failure Ann Intern Med. 2000;132:636-640.
- Kishimoto C., Tomioka N., Nakayama Y., Miyamoto M. Anti-oxidant effects of coenzyme Q10 on experimental viral myocarditis in mice. J Cardiovasc Pharmacol. 2003;42(5):588-92.
- Kodde I.F., van der Stok J., Smolenski R.T., de Jong J.W. Metabolic and genetic regulation of cardiac energy substrate preference. Comp Biochem Physiol A Mol Integr Physiol. 2007; 146(1):26-39.
- Lakatta E.G. Sollott S.J. The “Heartbreak” of Older Age? 2002
- Lakatta E.G. Arterial and cardiac aging: major shareholders in cardiovascular disease enterprises: Part III: cellular and molecular clues to heart and arterial aging. Circulation. 2003; 107: 490-497.
- Langsjoen P.H., Vadhanavikit S., Folkers K. Long-term efficacy and safety of coenzyme Q10 therapy for idiopathic dilated cardiomyopathy. Am J Cardiol. 1990; 65:521-3.
- Lesnefsky E.J., Moghaddas S., Tandler B. et al. Mitochondrial dysfunction in cardiac disease: ischemia-reperfusion, aging, and heart failure. J Mol Cell Cardiol 2001; 33: 1065–1089.
- Li G., Jack C.R., Yang X.F., Yang E.S. Diet supplement CoQ10 delays brain atrophy in aged transgenic mice with mutations in the amyloid precursor protein: an in vivo volume MRI study. Biofactors. 2008; 32(1-4):169-78.
- Lim S.C., Tan H.H., Goh S.K. et al. Oxidative burden in prediabetic and diabetic individuals: evidence from plasma coenzyme Q(10). Diabet Med. 2006;23(12):1344-9.
- Littarru G.P., Ho L., Folkers K. Deficiency of Coenzyme Q10 in human heart disease–part II. Int J Vit Nutr Res 1972; 42:413–434.
- Littarru G.P., Tiano L. Bioenergetic and antioxidant properties of coenzyme Q10: recent developments. Mol Biotechnol. 2007;37(1):31-7.
- Liu J., Ames B.N. Reducing mitochondrial decay with mitochondrial nutrients to delay and treat cognitive dysfunction, Alzheimer's disease, and Parkinson's disease. Nutr Neurosci. 2005; 8(2):67-89.
- Miles M.V., Horn P.S., Tang P.H. et al. Age-related changes in plasma coenzyme Q10 concentrations and redox state in apparently healthy children and adults. Clin Chim Acta. 2004; 347(1-2):139-44.
- Molyneux S.L., Florkowski C.M., George P.M. et al. Coenzyme Q10: an independent predictor of mortality in chronic heart failure. J Am Coll Cardiol. 2008; 28;52(18):1435-41.
- Moreira P.I., Santos M.S., Sena C. et al. CoQ10 therapy attenuates amyloid beta-peptide toxicity in brain mitochondria isolated from aged diabetic rats. Exp Neurol. 2005;196(1):112-9.
- Mortensen S.A. Overview on coenzyme Q10 as adjunctive therapy in chronic heart failure. Rationale, design and end-points of "Q-symbio"--a multinational trial. Biofactors. 2003;18(1-4):79-89.
- Müller T., Büttner T., Gholipour A.F., Kuhn W. Coenzyme Q10 supplementation provides mild symptomatic benefit in patients with Parkinson's disease. Neurosci Lett. 2003 8;341(3):201-4.
- Nessler J., Skrzypek A. Chronic heart failure in the elderly: a current medical problem Pol Arch Med Wewn 2008; 118 (10): 572-579.
- Pepe S., Marasco S.F., Haas S.J. et al. Coenzyme Q10 in cardiovascular disease. Mitochondrion. 2007;7 Suppl:S154-67.
- Quinzii C.M.., Hirano M., DiMauro S. CoQ10 deficiency diseases in adults Mitochondrion. 2007; 7(Suppl): S122–S126.
- Remme W.J. Heart failure management: why evidence does not influence clinical practice // Europ. Heart J. - 2000. – Vol.21 (Suppl.1) – P.I15-I21.
- Rosano G.M., Fini M., Caminiti G., Barbaro G. Cardiac metabolism in myocardial ischemia. Curr Pharm Des. 2008;14(25):2551-62.
- Rosenfeldt F.L., Haas S.J., Krum H. еt al. Coenzyme Q10 in the treatment of hypertension: ameta-analysis of the clinical trials. JHum Hypertens. 2007;21(4):297-306.
- Sander S., Coleman C.I., Patel A.A. et al. The impact of coenzyme Q10 on systolic function in patients with chronic heart failure. J Card Fail. 2006;12(6):464-72.
- Shah S.A., Sander S., Cios D. et al. Electrocardiographic and hemodynamic effects of coenzyme Q10 in healthy individuals: a double-blind, randomized controlled trial. Ann Pharmacother. 2007;41(3):420-5.
- Singh U., Devaraj S., Jialal I. Coenzyme Q10 supplementation and heart failure. Nutr Rev. 2007;65(6 Pt 1):286-93.
- Sodi Pallares D. Polarizing treatment in cardiology Cardiol Prat. 1970; 21(1):1-10.
- Stanley W.C., Recchia F.A., Lopaschuk G.D.Myocardial Substrate Metabolism in the Normal and Failing Heart. Physiol Rev 2005; 85:1093-1129.
- Tarnopolsky M.A., Raha S. Mitochondrial myopathies: diagnosis, exercise intolerance, and treatment options. Med Sci Sports Exerc. 2005;37(12):2084-5.
- Tendera M. Ageing and heart failure: the place of ACE inhibitors in heart failure with preserved systolic function // Europ. Heart J. - 2000. – Vol.2 (Suppl.1) – P.I8-I14
- Tiano L., Belardinelli R., Carnevali P. et al. Effect of coenzyme Q10 administration on endothelial function and extracellular superoxide dismutase in patients with ischaemic heart disease: a double-blind, randomized controlled study. Eur Heart J. 2007;28(18):2249-55.
- van Bilsen M., Smeets P.J.H., Gilde A.J., van der Vusse G.J. Metabolic remodelling of the failing heart: the cardiac burn-out syndrome? Cardiovascular Research 2004; 61:218– 226.
- Vogels R.L., Scheltens P., Schroeder-Tanka J.M., Weinstein H.C. Cognitive impairment in heart failure: a systematic review of the literature. Eur J Heart Fail. 2007; 9(5):440-9.
- Yang X., Yang Y., Li G. et al. Coenzyme Q10 attenuates beta-amyloid pathology in the aged transgenic mice with Alzheimer presenilin 1 mutation. J Mol Neurosci. 2008;34(2):165-71.
3. Горохова С.Г. Хроническая сердечная недостаточность в пожилом возрасте. Диагностика как основа лечения // Клин. геронтология. 2001, № 10, с. 32-39.
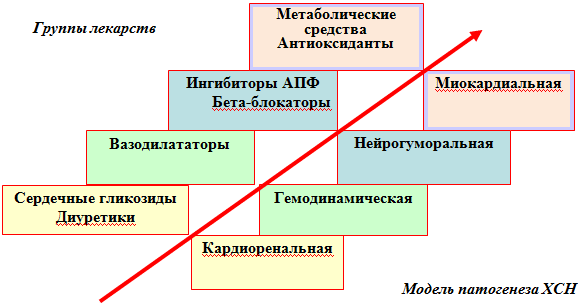
Рисунок 1. Лекарственная терапия с точки зрения развития концепций
патогенеза хронической сердечной недостаточности
Лекарственные средства, применяемые для модуляции метаболического ремоделирования при ХСН
|
цель
|
лекарственные средства |
|
подавление нейрогуморальной активации |
ингибиторы АПФ, антагонисты АТ1-рецепторов, адреноблокаторы, антагонисты альдостерона |
|
оптимизация захвата глюкозы
|
глюкозо-инсулин-калиевая смесь |
|
оптимизации окисления глюкозы
|
триметазидин, ранолазин, этомоксир, L-карнитин |
|
снижение уровня свободных жирных кислот
|
глюкозо-инсулин-калиевая смесь, инсулин, пергексилин |
|
снижение уровня свободных радикалов
|
коэнзим Q10, антиоксиданты |
|
снижение инсулинорезистентности |
глитазоны, бигуаниды (метформин) |
|
снижение потребления энергии |
ранолазин, бета-блокаторы |
ПОЖАЛУЙСТА, ОСТАВЬТЕ ВАШЕ МНЕНИЕ О СТАТЬЕ В КОММЕНТАРИЯХ
АптекиБольницыСкорая медицинская помощьПоликлиники |
ДиспансерыАкушерство и Гинекология |
Медицинские центрыСервис онлайн записи к врачу |
