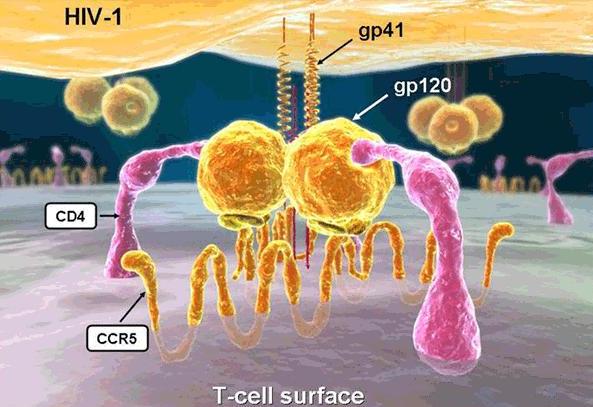
Мутации в гене оболочки gp41, ассоциируемые с резистентностью ко входным ингибиторам.
Мутации М184 могут увеличивать чувствительность к АЗТ, Зериту или Тснофовиру. Клиническое значение их неизвестно.
Недавние данные по обратным мутациям в кодоне 215 обнаружили, что T215DCSENAV замещения могут вызывать резистентность к АЗТ и Зериту при назначении их "наивным" больным.
Мутации в кодоне 75(V75TMSA ) наблюдались in vitro, и могут быть связаны с низким уровнем изменений чувствительности к Зериту.
K65R мутации или L74V мутации и/или в комбинации с T69DN могут приводить к резистентности к Видексу.
Основываясь на предварительных, неопубликованных данных, M184V мутация не вызывает негативных воздействий в in vivo реакциях на Видекс, даже несмотря на то, что мутация снижает чувствительность in vitro.
В присутствии с NAMs, M184V мутация содействует уменьшению чувствительности к Абакавиру, и связано с ослабленной реакцией in vivo. Тем не менее, в одиночку, MI84V мутация не ассоциируется с пониженной вирусной реакцией к Абакавиру in vivo.
E44D и VI181 мутации сравнимы с низкой резистентностью к Эпивиру, когда сопровождаются некоторыми другими ассоциированными с НИОТ мутациями (М41L, D67R L210 W, ТЗ15 YF, K219QE) в отсутствие совместной М184 V мутации.
Аккумуляция NAMs (М41L, D67N, K70R, L210W, Т215YF, K219QF (не включая E44D и V1181)) повышают резистентность к Тенофовиру. Мутации М41L и L210W способствуют этому больше других. Поэтому, номер и тип NAMs будет определять степень понижения чувствительности. T69DNS может также содействовать снижению чувствительности к Тенофовиру.
НИОТ-ассоциируемые мутации (NAMs), включая M4IL, IЈ44D, D67N, K70R. VI181. L210W, T215YF, и K219QB ассоциируются с кросс-резистснтностью к ПИОТ- они изображены розовыми линиями в позициях. E44D и VI181 мутации названы как NAMs в последних исследованиях. E44D и VI181 мутации были наиболее частыми у больных, получавших АЗТ и Эпивир и ассоциировались с высоким уровнем резистентности к АЗТ. При наличии с совместной с другими NAMs E44D и VI181 мутации сравнимы с резистентностью к Эпивиру. Анализ группы АСТУ показал, что E44D мутации обычно вырабатываются при АЗТс1с11 режиме.
Превалентность Y318F мутации в клинических изоляторах вместе с мутациями K.103N, Y181C и P236L было приблизительно 5%, 2% и 15% соответственно. In vitro эти мутации сравнительны с резистентностью к Невирапину и Ифавиренцу.
Y181CI мутация не создается Ифавиренцем , но ее присутствие способствует кросс-резистентности низкого уровня к лекарству. Клиническое действие этой мутации может быть преодолено более активным антиретровирусным режимом, хотя отсутствие опытных клинических данных еще ставит под сомнение этот вопрос.
V108I и Р225Н способствуют развитию резистентности к Ифавиренцу, когда присутствуют в комбинации с другими ННИОТ-ассоциируемыми мутациями. Хотя VI081 или Р225Н в одиночку не сравнимы с измеримой резистентностью лабораторных штаммов ВИЧ-1, их наличие в клинических изолятах может засечь первичную селекцию вариантов, устойчивых к Ифавиренцу.
Аккумуляция 2 или более подобных мутаций существенно уменьшает клиническую пользу всех распространенных ННИОТ.
K103N или Y188L мутации в одиночку могут уменьшать клиническую значимость ННИОТ.
V106М мутация сравнима с резистетностью высокого уровня in vitro к Невирапину и Ифавиренцу. Эта мутация наблюдалась только ВИЧ С клинических изолятах., хотя site-directed мутагенез показывает , что V106M сравним с кросс-резистентностью ко всем ННИОТ в ВИЧ В.
Резистентные мутации в гене протеазы классифицируются на "major " и "minor".
- Major:
В-основном, major мутации образуются сначала в присутствии лекарств; или проявляются на биохимическом или вирусологическом уровне как альтернатива медикаментозного связывания или торможения вирусной активности или репликации. Major мутации оказывают влияние на фенотип. В-основном, эти мутации являются последствиями медикаментозного лечения.
- Minor:
Главным образом, minor мутации возникают позднее major мутаций, и особого влияния на фенотип не имеют. В некоторых случаях, их воздействие может быть вызвано репликативной активностью major мутаций.
Для Индинавира, мутации, показанные как major, могут не быть первыми проявившимися, так, как они присутствуют в большинстве клинических изолятов в комбинации с остальными мутациями.
Major и minor мутации не были определены для ЛопинавирРитонавир- ассоциируемой резистентности, так, как нет ясных данных, определяющих степень воздействия с этой лекарственной комбинацией. Аккумуляция 6 или более таких мутаций ассоциируется с уменьшенной реакцией на ЛопинавирРитонавир. Информация по продукту сообщает, что аккумуляция 7 или 8 мутаций сравнима с резистентностью к лекарству. Несмотря на это, недавние сведения предполагают, что но меньшей мере 4 мутации могут быть ассоциированы с резистентностью такого высокого уровня. Дальнейшие клинические опыты и исследования нуждаются в лучшем определении мутаций, которые воздействуют на клиническую эффективность ЛопинавираРитонавира. Это является причиной, чтобы учитывать фенотип для определения индивидуальных особенностей.
Мутация протеазы L63P является общей для вирусов, которые никогда не подвергались действию ингибиторов протеазы и может быть более превалентной в вирусах у пациентов, у которых ИП-составляюший режим был провален. В то же время , самостоятельно. L63P не вызываетзаметных повышений в 1С50 для каждого ИП. L63P показана для ЛопинавираРитонавира (но не других ИП) потому, что исследования показали, что эта мутация в присутствии множества других мутаций ассоциирована с клиническим провалом.
Когда Атазаноиир назначается пациентам как начальный ИИ, то он приводит к мутации 150L и А71V. Когда он используется как дополнительный виестес Саквинавиром, то приводит к I54L и 184V. In vitro, Атазачовир приводит к V32I, М461, I84V и N88S. Хотя другие major мутации не вызываются Атазаповиром как in vivo, так и in vitro, эти мутации связываются с кросс- резистентностью к Атазановиру, особенно в комбинации с другими известными ИП- резистентными мутациями.
Аккумуляция 4 и более таких мутаций может вызвать мульти-ИП резистентность.
По данным, резистентные мутации в оболочечном гене gp41 первично идентифицированы на позициях с 36 по 45 на первом heptad repeat region(HRl). Эти мутации были идентифицированы в вирусах пациентов, подвергавшихся медикаментозному лечению и сравнимы с резистентностью или пониженной восприимчивостью. Важно отметить, что вирусы дикого типа показаны 500-fold range в восприимчивости и мутации в других частях оболочки может повлиять на восприимчивость к Энфувиртиду. Дальнейшие исследования нуждаются в оценке клинической уместности этих мутаций.
Для каждого аминокислотного остатка буква над строкой показывает аминокислоту, ассоциируемую с диким типом вируса, а буква(ы) под строкой показывают изменения, связанные с развитием вирусной резистентости. Номер показывает позицию мутации в белке. Мутации, вызванные ингибиторами протеазы в Gag clearage sites не показаны, так, как их содействие в выработке резистентности еще не полностью изучено.
ПОЖАЛУЙСТА, ОСТАВЬТЕ ВАШЕ МНЕНИЕ О СТАТЬЕ В КОММЕНТАРИЯХ
АптекиБольницыСкорая медицинская помощьПоликлиники |
ДиспансерыАкушерство и Гинекология |
Медицинские центрыСервис онлайн записи к врачу |
