Клиническая фармакология взаимодействий цинка и железа
Громова О.А. 1,2, Торшин И.Ю.1,3, Томилова И.К. 1,2, Федотова Л.Э.1,2
2ГОУ ВПО Ивановская Государственная Медицинская Академия Росздрава
В настоящей работе рассматриваются клинико-фармакологические характеристики цинка и железа, механизмы взаимодействия данных минералов в организме и данные клинических исследований. Совокупность имеющихся данных позволяет предположить, что наиболее оптимальным способом восполнения физиологических суточных потребностей в железе и цинке является прием во время еды, раздельный прием данных веществ в течение суток и при молярном соотношении компонентов 1:1.
Clinical pharmacology of the interactions between the zinc and the iron
Gromova OA 1,2,, Torshin I.Yu.1,3, Tomilova I.K. 1,2,, Fedotova L.E. 1,2,
1RSC of the Trace Element Institute for UNESCO
2Ivanovo State Medical Academy
3Computing Center of RAS
In this work, we carried out a systematic analysis of interactions of the two essential trace elements, iron and zinc. We consider the biological functions of these micronutrients, their pharmacokinetics and pharmacodynamics, the mechanisms of interaction of these minerals in the body and the findings from clinical studies. The totality of available data suggests that the best way of replinish the daily need (recommended daily allowance, RDA) of these two minerals would be separate intake of the substances in the 1:1 ratio and during the food intake.
Клиническая фармакология цинка и железа включает в себя не только фармакокинетику и фармакодинамику каждого элемента в отдельности, но и разбирает важный вопрос взаимодействия элементов между собой. Часто, пациенты нуждаются в совместном назначении и цинка, и железа. Действительно, многочисленные эпидемиологические и клинические исследования указывают, что сочетанные дефициты цинка и железа встречаются очень часто [1,2]. В России дефицит цинка и железа относятся к самым распространенным. В среднем по России дефицит цинка отмечается у 20%, у детей – до 40%, дефицит железа – у 22%. По разным оценкам, и дефицит цинка и дефицит железа одновременно встречается у 6-20% [2].
В то же время, результаты клинико-фармакологических испытаний фармацевтических форм, содержащих железо и цинк одновременно, указывают на взаимный антагонизм между железом и цинком: железо уменьшает положительные эффекты цинка и наоборот [2-6]. Поэтому, при проведении рационального дизайна элемент-содержащих и витаминных препаратов следует учитывать не только фармакологические свойства отдельных компонентов, но также и их взаимодействия, антагонизм и синергизм. К сожалению, взаимодействиями типа «микроэлемент-микроэлемент», «микроэлемент-витамин» и «витамин-витамин» часто пренебрегают.
Анализ более 1000 публикаций по молекулярной фармакологии и биохимии за последние 40 лет показал, что между этими элементами существуют значительные физиологические и лекарственные взаимодействия, как синергидные, так и конкурентные. В настоящей статье, после рассмотрения фундаментальных функций и фармакокинетики обоих микроэлементов, последовательно разобраны все виды их взаимодействия, в том числе и молекулярная фармакология цинка и железа [7,8].
Биологические функции железа, в целом, заключаются в транспорте электронов, кислорода, обеспечении окислительно-восстановительных реакций и активации перекисного окисления, предварительно подготовленного ионами меди. Железо жизненно необходимо для нормального функционирования иммунной системы (Т-лимфоциты, фагоцитоз). Этот микроэлемент необходим для формирования костей и нервной системы, для работы желудочно-кишечного тракта, эндокринных желез.
Тело человека содержит от 3 до 5 г железа. На гемоглобин приходится 75—80% этого количества; 5—10% — в составе миоглобина; 1% — в дыхательных ферментах, катализирующих процессы дыхания в клетках и тканях. Около 25% всего железа депонировано, преимущественно в печени и мышцах. Таким образом, основная масса железа приходится на гемоглобин эритроцитов, миоглобин мышц и на резервные белки — ферритин и гемосидерин. Около 1% от всего железа содержится в железосодержащих ферментах и переносится кровью в виде трансферрина.
С учетом 10 % усвоения суточные нормы потребления железа составляют для детей до 1 года составляет 4-10 мг, от 1 года до 3 лет – 5 мг, а с 4 лет – 8 мг . Суточная норма железа для мужчин 10 мг, для женщин 18 мг (для беременных - 20 мг, кормящих грудью - 25 мг).
Всасываемость железа в кишечнике взрослого человека составляет приблизительно 20% от его содержания в обычном рационе. Железо абсорбируется почти полностью в двенадцатипёрстной кишке (90-95%) и только 5-10% всасывается в начальных отделах тощей кишки. Чтобы быть абсорбированным, железо должно быть в двухвалентной форме и фермент ферроредуктаза восстанавливает ионы Fe3+ до Fe2+.
Интенсивность всасывания железа зависит от многих факторов, включая запасы железа в организме, интенсивность образования эритроцитов в костном мозге, концентрацию гемоглобина крови. Всасыванию железа способствуют простые углеводы — лактоза, фруктоза, сорбит, и аскорбиновая кислота, и аминокислоты гистидин, лизин, цистеин. Усвоение железа снижается при воспалении, трансфузионной полицитемии, дефиците меди, никеля и избытке кальция. Кофе и чай могут уменьшить способность усваивать Fe за счет связывания полифенольными соединениями. Уменьшается поглощение железа и при связывании с т.н. «пищевым консервантом» ЭДТА (этилендиаминтетрауксусная кислота), фитатами, клетчаткой и фосфатами.
Неорганические формы железа, такие как гидроксид или хлорид плохо усваиваются (биодоступность 3-5%), биодоступность сульфата железа не превышает 15% и не достигает намного более высокой биодоступности органических форм (сукцинат, фумарат, глюконат).
Биоусвоение железа организмом не может быть рассматриваемо в отрыве от других витаминов и микроэлементов. Дефицит витамина А уменьшает способность к усвоению Fe; железо желательно принимать вместе с антиоксидантами — витаминами С и Е. Например, аскорбиновая кислота повышает биодоступность железа и восстанавливает окисленное, трехвалентное железо до биологически необходимого двухвалентного. Также, необходимо получать адекватное количество витаминов группы В — рибофлавина и пиридоксина в рационе, чтобы нормально усваивать и использовать железо.
Железо в организме человека находится в двух физиологических состояниях: или в виде запасов в ретикулоэндотелиальной системе — печени, селезенке, костном мозге, или в активном функциональном состоянии, в эритроцитах и в их предшественниках. Молекулярные механизмы транспорта и гомеостаза железа достаточно сложны. В целом в геноме человека существует не менее 230 генов, белки которых вовлечены в гомеостаз железа или необходимых для проявления биологических функций этого микроэлемента. Гомеостаз железа включает десятки различных белков, каждый из которых имеет уникальную функцию, без выполнения которой происходят тяжелые нарушения гомеостаза железа. Наиболее известны из всех белков трансферрин (ТФ) и ферритин (ФТ) - основные транспортные белки железа.
Трансферрин отличается высоким сродством к иону железа. Хотя количество железа, связанное с трансферрином составляет около 0.1% (4 мг) всего железа в организме, трансферрин доставляет железо тканям, имеющим специфические мембранные рецепторы (например, предшественники эритроцитов в костном мозге, клетки нервной системы). Молекула трансферрина, нагруженная двумя ионами железа, взаимодействует с трансферриновым рецептором на поверхности клетки, и транспортируется внутрь клетки. В ходе транспорта, рН пузырька (везикулы) понижается особой разновидностью АТФаз, что приводит к высвобождению ионов железа. Перенос железа через трансферрин невозможен без АТФ и, таким образом, является энергозависимым, активным транспортом. Рецептор и молекула трансферрина высвобождаются и возвращаются на поверхность клетки для переноса новой порции ионов железа [9].
Железо, высвободившееся из трансферрина, связывается специфическим белком ферритином, который доставляет железо в митохондрии, где оно включается в состав гема с участием феррохелатазы. Ферритин осуществляет внутриклеточное хранение Fe и представляет собой контейнер, в полости которого может поместиться ~4500 ионов Fe3+. Максимальная концентрация этого транспортера определена в печени, селезенке, костном мозге, преимущественно в эндотелиоцитах. Запасание железа в окисленной форме препятствует его вовлечению в окислительные процессы [1].
Трансферрин и ферритин, однако – всего лишь две составные части намного более сложной системы гомеостаза железа. Белок «HFE» (вариации гена HFE считаются одной из причин гемохроматоза) регулирует взаимодействие трансферрина с рецепторами.
Пептид гепцидин – один из недавно найденных центральных факторов регуляции железа. Гепцидин связывает гемопортин на мембранах энтероцитов, макрофагов и гепатоцитов. Комплекс гепцидин-гемопортин всасывается внутрь клетки, что приводит к сокращению экспорта железа и, следовательно, к более низкому уровню железа в плазме. Уровни гепцидина увеличиваются при перегрузке железом и уменьшаются с недостатком железа. [10].
В организме человека содержится 1.5-2.5 г цинка, из них 90% концентрируется в цинковом депо - скелетной мускулатуре (60%) и в костях (30%). Цинк — внутриклеточный металл и особенно концентрируется в печени, мышцах, предстательной и поджелудочной железе, глазном яблоке, гипофизе, гипоталамусе и обонятельных луковицах. Лишь 2% этого элемента определяется в сыворотке, а в плазме - лишь 0,1% всего цинка. Суточная потребность человека в цинке составляет 8-15 мг для взрослых (11 мг - мужчины; 8мг - женщины; 15 мг – у лиц испытывающих повышенные физические нагрузки, у беременнх и кормящих – 20-25 мг). Потребность в цинке у детей 0–12 месяцев составляет 3–4 мг, 1–6 лет – 5–10 мг, 7–17 лет – 10–15 мг.
Ключевым этапом усвоения цинка является тонкокишечная рециркуляция, заключающаяся в поддержании баланса между абсорбцией элемента и его эндогенной секрецией панкреатическими и интестинальными клетками. Всасывание цинка происходит в верхнем отделе кишечника, причем в 12-перстной кишке поглощается 40-45%, а в тощей и подвздошной – 15-21%. В желудке и прямой кишке всасывается не более 2% цинка.
В зависимости от лигандной формы цинка (пиколинат, оксид и др.), всасывается от 50% до 85% от поступившего с пищей и водой цинка. Абсорбция увеличивается по мере снижения содержания элемента в пищевом рационе. Неорганические формы цинка имеют низкую биодоступность (менее 10%).
Улучшают всасывание цинка белок миозин, содержащийся в пище, глицин, глутаминовая кислота, цистеин, гистидин, лактоза, гонадотропин, глюкокортикостероиды, а также витамины А и В6. Дефицит витамина А сопровождается недостаточным синтезом транспортных белков, необходимых для всасывания и циркуляции цинка в организме. Ухудшают всасывание цинка воспалительные процессы в слизистых оболочках желудка и кишечника, фитиновая кислота, кальций, фосфаты, железо, медь, магний, марганец. Кадмий и свинец способны вытеснять цинк из организма. Выделение цинка осуществляется в основном с калом (в т.ч. с клетками слущивающегося эпителия), значительно меньше — с потом и мочой. Период полуэлиминации цинка составляет от 20 суток до 1 года [1].
Анализ генома человека показывает, что существуют не менее 1700 белков, так или иначе взаимодействующих с цинком. Значительная часть этих белков – транскрипиционные факторы типа «цинковый палец», необходимые для активации транскрипции многих тысяч генов [7].
Рисунок 1. Структура типа «цинковый палец». Зеленая сфера – ион цинка.

Например, все рецепторы стероидов содержат ДНК-взаимодействующий домен, который не может активироваться при отсутствии цинка в структуре рецептора. В настоящее время известно, что цинк необходим для функции нескольких сотен ферментов, которые участвуют в различных метаболических процессах, включая синтез и распад углеводов, жиров, белков и нуклеиновых кислот и др. Следует отметить наиболее важные функции цинка: метаболизм белков и углеводов, влияние на рост и деление клеток, кислотный баланс крови, участие в иммунитете, участие в реакциях антиоксидантной защиты и метаболизм ретинола, необходимого для образования зрительного пигмента.
Так как существует более 1700 белков для которых цинк необходим (по некоторым оценкам, 3000 [12]), то становится понятной вся сложность гомеостаза цинка. Парадоксально, но гомеостаз железа, к настоящему времени, изучен намного более подробно, чем гомеостаз цинка. В плазме, примерно 18% цинка связано с альфа-2-макроглобулином, 80% - с альбумином и 2% с транспортными белками, такими как трансферрин, церулоплазмин и металлотионеины. Альфа-2-макроглобулин и альбумин осуществляют неспецифический транспорт ионов металлов, а трансферрин, церулоплазмин и металлотионеины – специфический транспорт.
Металлотионеины (МТ) являются плейотропными низкомолекулярными белками богатыми цистеином. В настоящий момент у человека известны 4 класса МТ, насчитывающие 16 изоформ [13]. Металлотионеины имеют молекулярную массу до 6-7кДа и способны связывать широкий спектр металлов, в том числе и токсичных (Pb, Cd), тем самым имея антиоксидантный эффект. Ионы металлов индуцируют экспрессию металлтионеинов в различных тканях (мозг, печень, миокард и т.д.).
Как цинк-, так и железо-содержащие белки работают во всех физиологических системах организма и взаимодействуют на разных уровнях иерархии управления гомеостазом. На наш взгляд, наиболее фундаментальным представляется физиологическое взаимодействие на уровне дыхательной системы (обмен O2/CO2) и регуляции pH крови.
Железо входит в состав гемоглобина – основного транспортного белка кислорода. Гемоглобин, основной белок эритроцитов, обратимо связывается с кислородом в капиллярах лёгких. Током крови эритроциты доставляются ко всем органам и тканям и необходимый для протекания окислительных процессов кислород освобождается из связи с гемоглобином. Эртироциты также переносят углекислый газ и выделяют его в капиллярах лёгких одновременно с забором кислорода.
В гемоглобине простетической группой выступает гем. Гем - комплекс протопорфирина IX с ионом железа (II). Связываемая гемоглобином молекула кислорода координируется к железу и оказывается заключённой между ионом железа и аминокислотными остатками гемоглобина.
Эритроциты переносят кислород посредством гемоглобина и способствуют удалению углекислого газа. Для этого процесса абсолютно необходим цинк: большая часть цинка крови содержится именно в эритроцитах в составе цинковых металлоферментов - карбоновых ангидраз. Карбоангидразы – ферменты, взаимопревращающие угольную кислоту и углекислый газ, H2CO3↔CO2↑+H2O. Угольная кислота является как депо углекислоты, выделяющейся при клеточном дыхании, так и основным компонентом карбонатного буфера, поддерживающего pH крови в физиологическом диапазоне (pH =7.25-7.35) [7].
Таким образом, с физиологической точки зрения, железо и цинк участвуют в двух комплементарных процессах дыхания: транспорте кислорода и элиминации углекислоты. При недостатке любого из микроэлементов, нарушается баланс O2/CO2 . Так как цинк также способствует поддержанию кислотности крови на должном уровне, недостаток цинка будет способствовать сдвигу pH крови в сторону ацидоза.
И гомеостаз цинка, и гомеостаз железа – крайне сложные явления, взаимодействия которых могут происходить на многих уровнях. Поэтому, представляется целесообразным последовательно рассмотреть все известные разновидности лекарственного взаимодействия как то фармацевтическое, фармакокинетическое, и фармакодинамическое взаимодействия с учетом всей вышеприведенной информации касательно обмена железа и цинка.
Фармацевтическое взаимодействие веществ подразумевает протекание химической реакции (например, реакция между щелочами и кислотами, окислительно-восстановительные реакции, воздействие УФО и др.) между компонентами лекарства до поступления в организм. Как известно из основ химии железа и цинка [15], в обычных условиях жизнедеятельности человека химическое взаимодействие между ними в принципе невозможно, так как оба эти элемента представлены катионами, не образуют окислительно-восстановительную пару и, в общем случае, не могут образовывать нерастворимый осадок.
Возможны, однако, взаимодействия между некоторыми конкретными соединениями цинка и железа. Например, совмещение в одном препарате субстанций карбоната цинка и любой соли водорастворимой соли железа (сульфата, нитрата, фумарата) приведёт к выпадению осадка из карбоната и гидроксида железа при попадании воды в лекарственную форму (уравнение реакции типа FeSO4 + ZnCO3 = FeCO3↓ + ZnSO4). Следует избегать совместного применения любых карбонатов (карбоната цинка, карбоната кальция и др.) и любых форм железа. Это правило хорошо известно в фармацевтике и обязательно учитывается в технологии изготовлении лекарств.
Следует избегать совместного применения любых карбонатов (карбоната цинка, карбоната кальция и др.) и любых форм железа.
Экспериментальные и клинические исследования фармакокинетики железа и цинка при совместном применении показывают, что ингибирование цинком всасывания железа зависит от их соотношения. При молярном соотношении Fe:Zn ниже 2:1, у нормальных крыс никакого существенного влияния железа на цинк не наблюдалось. При более высоких соотношениях, усвоение цинка значительно уменьшилось (р<0.05), а при отношении Fe:Zn равном 5:1 дозозависимое торможение поглощения цинка перестает увеличиваться [16]. Иначе говоря, увеличение соотношения Fe:Zn более 5:1 не приводит к дальнейшему ухудшению всасывания цинка.
В исследовании 22 добровольцев, каждый получал 0.5 мг препарата железа с различным соотношением цинка, никакого существенного влияния цинка на всасывание железа не было найдено при молярных соотношениях Zn:Fe менее 2:1 [17,18]. При соотношениях 5:1, 10:1 и 20:1, наблюдалось 28-40% торможение поглощения железа (P=0.02). В других исследованиях, при соотношениях 1:1 наблюдалось самое слабое торможение всасывания цинка, менее 10% [3, 19]. Эти и другие клинические исследования показали, что высокие концентрации железа могут ингибировать абсорбцию цинка и наоборот. (краткое описание этих исследований приведено в таблице 1). Таким образом, при создании комплексов, включающих цинк и железо, следует стремиться к молярному соотношению цинка к железу 1:1, и по возможности разделять их прием в течение суток.
Как показывает совместный анализ результатов этих исследований, угнетающее воздействие железа на всасывание цинка наблюдалось, в основном, только при приеме обоих минералов в жидкой фазе. В случае приема минералов с едой, угнетения всасывания цинка практически не наблюдалось. Используя критерий χ2 для данных в таблице нетрудно сосчитать, что этот результат был статистически значимым с высокой достоверностью (О.Ш. 52., 95% ДИ 5-570; P<0.0001). Иначе говоря, при приеме обоих минералов с жидкостью риск угнетения усваивания цинка возрастает в 52 раза. Как правило, в инструкциях по применению большинства витаминно-минеральных комплексов, включающих одновременно и цинк и железо, рекомендуется запивать таблетку/драже водой или другой жидкостью. Как показывают данные исследований (Таблица 1), выполнение этой рекомендации создает условия для антагонизма между цинком и железом на уровне всасывания в ЖКТ.
Таблица 1. Клинические исследования на здоровых добровольцах по изучению эффектов взаимодействия диетарных цинка и железа. «-Zn», уменьшенная абсорбция цинка.
|
Fe
mg
|
Zn
Mg
|
Fe:Zn
mg
|
Носитель
|
Эффект
|
Источник
|
|
25
|
25
|
1:1
|
Лимонад
|
-Zn (слабо) |
Solomons and Jacob, 1981 [19] |
|
50
|
25
|
2:1
|
Лимонад
|
-Zn
|
Solomons and Jacob, 1981 [19] |
|
75
|
25
|
3:1
|
Лимонад
|
-Zn
|
Solomons and Jacob, 1981 [19] |
|
100
|
54
|
1.9:1
|
Устрицы
|
нет
|
Solomons and Jacob, 1981 [19] |
|
50
|
25
|
2:1
|
Лимонад
|
-Zn
|
Solomons et al, 1983 [20] |
|
47
|
2.5
|
2:1
|
Вода
|
-Zn
|
Aggett et al, 1983 [21] |
|
100
|
50
|
2:1
|
Вода
|
-Zn
|
Meadows et al, 1983 [22] |
|
51
|
6
|
10:1
|
Вода
|
-Zn
|
Valberg et al, 1984 [6] |
|
26
|
6.2
|
5:1
|
Вода
|
-Zn
|
Valberg et al, 1984 [6] |
|
17
|
4
|
5:1
|
Индюшка
|
нет
|
Valberg et al, 1984 [6] |
|
34
|
4
|
10:1
|
Индюшка
|
нет
|
Valberg et al, 1984 [6] |
|
2.2
|
2.6
|
1:1
|
Вода
|
нет
|
Sandstrom et al, 1985 [23] |
|
5.6
|
2.6
|
2.5:1
|
Вода
|
нет
|
Sandstrom et al, 1985[23] |
|
56
|
2.6
|
25:1
|
Вода
|
-Zn
|
Sandstrom et al, 1985[23] |
|
2.2
|
2.6
|
1:1
|
Рис и мясо |
нет
|
Sandstrom et al, 1985[23] |
|
5.6
|
2.6
|
2.5:1
|
Рис и мясо
|
нет
|
Sandstrom et al, 1985[23] |
|
56
|
2.6
|
25:1
|
Рис и мясо
|
-Zn
|
Sandstrom et al, 1985[23] |
|
47
|
22
|
2.4:1
|
Вода
|
нет
|
Crofton et al, 1989 [3] |
|
24
|
27
|
1:1
|
Вода
|
-Zn (слабо) |
Crofton et al, 1989 [3] |
|
24
|
68
|
1:2.5
|
Вода
|
-Zn
|
Crofton et al, 1989 [3] |
|
3
|
15
|
1:5
|
Вода
|
-Zn
|
Rossander et al, 1991 [4] |
|
3
|
45
|
1:15
|
Вода
|
-Zn
|
Rossander et al, 1991 [4] |
|
3
|
15
|
1:5
|
Бутерброд
|
нет
|
Rossander et al, 1991 [4] |
|
10.3
|
0.4
|
23.3:1
|
Детское питание |
нет
|
Davidsson et al, 1995 [24] |
|
25.3
|
0.4
|
57.4:1
|
Детское питание |
нет
|
Davidsson et al, 1995 [24] |
|
4.5
|
0.5
|
8.8:1
|
Бутерброд
|
нет
|
Davidsson et al, 1995 [24] |
|
5.5
|
0.5
|
10.2:1
|
Детск. Питание |
нет
|
Davidsson et al, 1995 [24] |
В 2006 году были опубликованы итоги многоцентрового исследования совместного и раздельного применения препаратов цинка и железа, в котором приняли участие около 2,5 тыс. детей. В результате было показано, что прием монодобавок железа не влияет негативно на концентрацию цинка в крови у детей. Однако прием монодобавок цинка может негативно влиять на статус железа. Совместный прием препаратов железа и цинка менее эффективен в предотвращении развития анемии, чем раздельный прием [30].
Другое исследование, проведенное в 2004 году с участием 650 детей, показало, что при приеме цинка значительно улучшается рост, железа — рост и психомоторное развитие, но в комбинации эти элементы не показывают значительного эффекта ни на рост, ни на развитие ребенка [31].
Фармакодинамическое взаимодействие цинка и железа имеет два аспекта: синергидный и конкурентный (антагонистический). Вряд ли можно отрицать существование синергизма между цинком и железа. Помимо упомянутого ранее физиологического взаимодействия, анализ функциональной взаимосвязи цинка и железа, проведенный нами по авторской методике [7,8] в геноме человека показал, что существует по крайней мере 230 генов, белки которых вовлечены в гомеостаз железа. Анализ указал на существование белков, которые могут выполнять свою биологическую функцию только при адекватных уровнях и цинка и железа. Ряд этих белков необходим для регулирования кислородного баланса и активируются при гипоксии. Известно, что совместное применение препаратов железа и цинка существенно улучшает показатели крови [25,26].
Особый интерес представляет синергизм между железом и цинком, обеспечивающий реакцию клеток на гипоксию. Эглнин-1 (известен также как «пролилгидроксилаза 2 фактора гипоксии») является сенсором кислорода в клетке. При связывании одной молекулы кислорода, эглнин включает гидроксилирование пролиновых остатков фактора гипоксии (HIF-1) помечая этот белок для убиквитин-зависимой деградации модулируя, тем самым, реакцию на гипоксию [27].
Ферменты NO синтетазы необходимы для синтеза одной из важных сигнальных молекул: оксида азота. Оксида азота II (NO, в химии известен как «окись азота») является нейромедиатором и вазодилататором. Окись азота синтезируется NO-синтетазами из аргинина по реакции L-аргинин + НАДФ + H+ + O2 = цитруллин + окись азота + НАДФ+. Ион железа является частью каталитического центра в составе гема, а ион цинка необходим для стабилизации пространственной структуры фермента (рис. 1) [28].
Существует и конкурентное взаимодействие цинка и железа. Ионы микроэлементов могут менять носители (связываться с определенными белками, например) и вызывать другие изменения в организме, изменяющие абсорбцию. Наиболее вероятным кандидатом на молекулярный механизм взаимодействия железа и цинка является транспортер типа ZIP14, вовлеченный в транспорт железа, не связанного с трансферрином и, также, в транспорт цинка (Рис. 2). В энтероцитах и других клетках, снабжённых белком ZIP14, транспорт посредством ZIP14 происходит, по всей видимости, под воздействием АТФ [9], т.е. является активным транспортом. Следует также принимать во внимание, что 60% цинка в плазме неспецифически связываются с альбумином, в то время как около 10% цинка переносятся самим трансферрином. Поэтому, избыток железа может тормозить абсорбцию цинка и наоборот [29].
Рисунок 2. Конкуренция между цинком и железом за транспортеры типы ZIP14, DMT1, ZnT и др. при разных условиях (избыток железа, соотношение 1:1, избыток цинка).
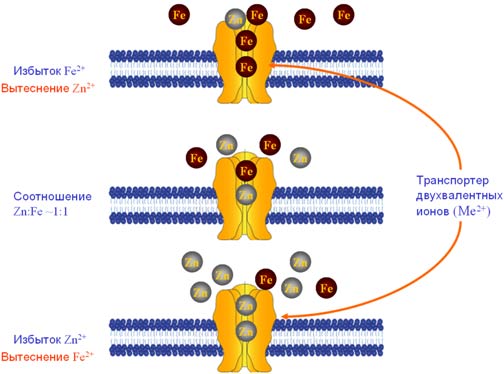
Сформулированная выше гипотеза о возникновении антагонизма между цинком и железом как следствие конкуренции за транспортные рецепторы подтверждается приведенными выше результатами экспериментальных и клинических исследований (исследования [3-5,20-23] и др.). Эти исследования показали, что только при высоких молярных соотношениях наблюдаются эффекты взаимодействия. Если бы взаимодействие было опосредованно через изменения уровней транскрипции, оно было бы уже заметным при молярных соотношениях порядка 1:1.
Взаимодействие цинка и железа — это сложный, многосторонний, быстро меняющийся во времени процесс, зависящий от множества факторов, характера пищи, фазы пищеварения, состояния пищеварительной системы, пропорции поступления этих элементов с пищей или в составе препаратов, а также от химической природы соединений-источников этих элементов (Рис. 3). Между цинком и железом имеется как несомненный физиологический и фармакодинамический синергизм, так и определенный антагонизм. Зачастую в клинической практике встречается сочетанный дефицит железа и цинка, что приводит к необходимости назначать совместный прием препаратов железа и цинка или использовать комплексные препараты. При одновременном поступлении в организм в жидкой среде, цинк и железо конкурируют за транспортные белки через конкурентное замещение. Для предотвращения конкуренции между цинком и железом следует соблюдать следующие важные правила (1) одновременный прием приведет к минимальному антагонизму, если соотношение Fe:Zn не превышает 1:1; (2) при раздельном приеме, конкуренция между цинком и железом за транспортные белки исключается, биодоступность элементов повышается;(3) при совместном приеме минералов, следует избегать приема с жидкостью, а принимать препарат во время еды.
Таким образом, оптимальным решением является прием железа и цинка в разное время в течение суток, поэтому следует отдавать предпочтение препаратам, учитывающим данное взаимодействие.
Рисунок 3. Результирующая схема антагонизма и синергизма цинка и железа.

1. Ребров В.Г., Громова О.А., Витамины, макро- и микроэлементы, М., ГэотарМед, 2008, 957С.
2. Kordas K, Stoltzfus RJ. New evidence of iron and zinc interplay at the enterocyte and neural tissues. J Nutr. 2004 Jun;134(6):1295-8. Review.
3. Crofton RW, Gvozdanovic D, Gvozdanovic S, et al. Inorganic zinc and the intestinal absorption of ferrous iron. Am J Clin Nutr 1989;50:141–4.
4. Rossander-Hulten L, Brune M, Sandstrom B, Lonnerdal B, Hallberg L. Competitive inhibition of iron absorption by manganese and zinc in humans. Am J Clin Nutr 1991;54:152–6.
5. Solomons N.W., Cousins R.J. (2004) Zinc. In Solomons N.W., Rosenberg I.H. (eds), Absorption and malabsorption of mineral nutrients. Alan R Liss, New York, pp 125-197.
6. Valberg LS, Flanagan PR, Chamberlain MJ. Effects of iron, tin, and copper on zinc absorption in humans. Am J Clin Nutr. 1984 Sep;40(3):536-41.
7. Torshin I.Yu. Bioinformatics in the post-genomic era: sensing the change from molecular genetics to personalized medicine. Nova Biomedical Books, NY, USA, 2009, In “Bioinformatics in the Post-Genomic Era” series, ISBN: 978-1-60692-217-0
8. Torshin I.Yu. Bioinformatics in the Post-Genomic Era: The Role of Biophysics, 2006 Nova Biomedical Books, NY, ISBN-10: 1-60021-048
9. Pietrangelo A. Physiology of iron transport and the hemochromatosis gene. Am J Physiol Gastrointest Liver Physiol. 2002 Mar;282(3):G403-14.
10. Borch-Iohnsen B, Hagve TA, Hauge A, Thorstensen K.Regulation of the iron metabolism.Tidsskr Nor Laegeforen. 2009 Apr 30;129(9):858-62.
11. Brooks WA, Santosham M, Naheed A, Goswami D, Wahed MA, Diener-West M, Faruque AS, Black RE.Effect of weekly zinc supplements on incidence of pneumonia and diarrhoea in children younger than 2 years in an urban, low-income population in Bangladesh: randomised controlled trial.Lancet. 2005 Sep 17-23;366(9490):999-1004.
12. Maret W. Molecular aspects of human cellular zinc homeostasis: redox control of zinc potentials and zinc signals. Biometals. 2009 Feb;22(1):149-57.
13. Thirumoorthy N, Manisenthil Kumar KT, Shyam Sundar A, Panayappan L, Chatterjee M.Metallothionein: an overview. World J Gastroenterol. 2007 Feb 21;13(7):993-6.
14. Cousins RJ, Blanchard RK, Moore JB, Cui L, Green CL, Liuzzi JP, Cao J, Bobo JA. Regulation of zinc metabolism and genomic outcomes. J Nutr. 2003 May;133(5 Suppl 1):1521S-6S.
16. Peres JM, Bureau F, Neuville D, Arhan P, Bougle D. Inhibition of zinc absorption by iron depends on their ratio. J Trace Elem Med Biol. 2001;15(4):237-41.
17. Olivares M, Pizarro F, Ruz M. New insights about iron bioavailability inhibition by zinc. Nutrition. 2007 Apr;23(4):292-5.
18. Olivares M, Pizarro F, Ruz M. Zinc inhibits nonheme iron bioavailability in humans. Biol Trace Elem Res. 2007 Summer;117(1-3):7-14.
19. Solomons NW, Jacob RA. Studies on the bioavailability of zinc in humans: effects of heme and nonheme iron on the absorption of zinc. Am J Clin Nutr 1981;34:475–82.
20. Solomons NW, Pinedea O, Viteri F, Sandstead H. Studies on the bioavailability of zinc in humans: mechanism of the intestinal interaction of nonheme iron and zinc. J Nutr 1983;113:337–49.
21. Aggett PJ, Crofton RW, Khin C, Gvozdanovic S, Gvozdanovic D. The mutual inhibitory effect on the bioavailability of inorganic zinc and iron. In: Prasad AS, Cavdar AO, Brewer GJ, Aggett PJ, eds. Zinc deficiency in human subjects. New York: Alan R Liss, 1983:117–24.
22. Meadows NJ, Grainger SL, Ruse W, Keeling PWN, Thompson RPH. Oral iron and the bioavailability of zinc. Br Med J 1983;287:1013–4.
23. Sandstrom B, Davidsson L, Cederblad A, Lonnerdal B. Oral iron, dietary ligands and zinc absorption. J Nutr 1985;115:411–4.
24. Davidsson L, Almgren A, Sandstrom B, Hurrell RF. Zinc absorption in adult humans: the effect of iron fortification. Br J Nutr 1995;74:417–25.
25. Berger J, Ninh NX, Khan NC, Nhien NV, Lien DK, Trung NQ, Khoi HH.Efficacy of combined iron and zinc supplementation on micronutrient status and growth in Vietnamese infants.Eur J Clin Nutr. 2006 Apr;60(4):443-54.
26. Wasantwisut E, Winichagoon P, Chitchumroonchokchai C, Yamborisut U, Boonpraderm A, Pongcharoen T, Sranacharoenpong K, Russameesopaphorn W.Iron and zinc supplementation improved iron and zinc status, but not physical growth, of apparently healthy, breast-fed infants in rural communities of northeast Thailand.J Nutr. 2006 Sep;136(9):2405-11.
27. Choi KO, Lee T, Lee N, Kim JH, Yang EG, Yoon JM, Kim JH, Lee TG, Park H. Inhibition of the catalytic activity of hypoxia-inducible factor-1alpha-prolyl-hydroxylase 2 by a MYND-type zinc finger. Mol Pharmacol. 2005 Dec;68(6):1803-9. Epub 2005 Sep 9.
28. Hemmens B, Goessler W, Schmidt K, Mayer B. Role of bound zinc in dimer stabilization but not enzyme activity of neuronal nitric-oxide synthase. J Biol Chem. 2000 Nov 17;275(46):35786-91.
29. Rink L, Gabriel P. Zinc and the immune system. Proc Nutr Soc. 2000 Nov;59(4):541-52. Review.
30. Wieringa F.T. et.al. Combined iron and zinc supplementation in infants improved iron and zinc status, but interactions reduced efficacy in a multicountry trial in Southeast Asia //J. Nutr. – 2007. – Feb; 137(2). – Р. 466–471.
31. Lind T, Lonnerdal B, Stenlund H. et al. A community-based randomized controlled trial of iron and zinc supplementation in Indonesian infants: effects on growth and development. The American journal of clinical nutrition. 2004 Sep; 80(3):729-36.
ПОЖАЛУЙСТА, ОСТАВЬТЕ ВАШЕ МНЕНИЕ О СТАТЬЕ В КОММЕНТАРИЯХ
АптекиБольницыСкорая медицинская помощьПоликлиники |
ДиспансерыАкушерство и Гинекология |
Медицинские центрыСервис онлайн записи к врачу |
