Главная / Статьи / Кардиология
Состояние эндотелиальной функции у больных хронической ишемической болезнью сердца на фоне применения коэнзима Q10
ГОУ ВПО Курский государственный медицинский университет,
Кафедра внутренних болезней №2.
Д.м.н., проф. В.П. Михин, к.м.н. А.В.Харченко, В.Г. Шарова, М.А. Чернятина, Е.В. Мальцева
Проведенные в последние годы экспериментальные и клинические исследования в этой области показали важную роль сосудистого эндотелия в развитии и прогрессировании атеросклеротического поражения артериального русла [1, 2].
Сосудистый эндотелий, имеющий общую площадь, равную площади футбольного поля, как известно, выполняет целый ряд функций в системе гомеостаза и может представлять как изолированный системный орган весом до 2,0 кг, регулирующий состояние центральной и регионарной гемодинамики, свертывающей системы, иммунного ответа, реакции воспаления и ряда других функций [2].
Однако, наиболее важной функцией, с точки зрения регионарной гемодинамики, является его вазорегулирующая активность, связанная с эндотелийзависимым расслабляющим фактором – оксидом азота (NO) и вазоконстрикторами, и в первую очередь, эндотелином-1. Выработка NO определяется экспрессией NO-синтазы и тесно связана с метаболизмом аргинина и арахидоновой кислоты [3, 4].
Активация свободно-радикальных процессов, нарушения внутриклеточного энергетического обмена, характерные для ИБС [5-8], инициируют нарушения экспрессии NO-синтазы, рецепторного аппарата сосудистой стенки и ускорение перекисной модификации молекулы оксида азота [8, 9, 10-12]. Такие изменения, предшествующие развитию локального атеросклероза, носят генерализованный характер, поражая сосудистый эндотелий, и ведут к формированию эндотелиальной дисфункции [2, 3, 13, 38].
Нарушение функции сосудистого эндотелия не только ускоряет развитие атеросклеротического процесса сосудистой стенки, но и снижает эффект антиангинальных и гипотензивных средств, так как их вазорегулирующая фармакологическая активность, в конечном итоге, реализуется за счет системы NO.
В этой связи, особый интерес вызывает использование в клинической практике препаратов, способных влиять на основные патогенетические звенья развития эндотелиальной дисфункции [14, 15], что может стать одним из основополагающих факторов первичной и вторичной профилактики атеросклероза и ИБС [8, 16, 9, 11, 12, 17].
Перспективным в этом отношении препаратом является препарат кудесан (коэнзим Q10) [18, 19], который обеспечивает внутриклеточную оптимизацию электрон-транспортной функции в цепи цитохромов, что улучшает энергетический баланс клетки. Коэнзим Q10 естественный клеточный метаболит, обладающий и антиоксидантными свойствами [20, 21, 22, 23], что делает его особо привлекательным при коррекции метаболических нарушений у больных хронической ИБС [8, 24, 25-27].
На сегодняшний день проведено ряд экспериментальных [20, 28, 29, 30] и клинических исследований [31, 32], результаты которых свидетельствуют об эффективности препарата кудесан в комплексной терапии сердечно-сосудистых заболеваний, в том числе и у больных с острыми и хроническими формами ИБС [17, 19, 25, 26, 27]. Вместе с тем, в большинстве работ исследовалось состояние сердечной мышцы и эффективность коронарного кровотока при лечении кудесаном, однако его влияние на дисфункцию сосудистого эндотелия изучено недостаточно, а имеющиеся результаты носят предварительный характер.
Цель исследования: изучить эффективность препарата кудесан (ЗАО «Аквион») как эндотелийпротективного препарата у больных хронической ИБС, стабильной стенокардией напряжения II-III ФК на фоне базисной антиангинальной терапии.
Исследование выполнено на двух рандомизированных группах больных ИБС, стабильной стенокардией напряжения II-III ФК: основная (80 человек) и контрольная (30 человек).
Пациенты обеих групп не менее чем за 2 мес. до начала исследования и в течение всего периода наблюдения получали традиционную базисную терапию, включавшую селективный β-адреноблокатор (метопролол 50-100 мг/сут), ацетилсалициловую кислоту (100-125 мг/сут), а у ряда больных с III ФК при недостаточной антиангинальной эффективности β-блокаторов лечение дополнялось пролонгированными нитратами (изосорбида-5-мононитрат – 40-60 мг/сут). Пациенты основной группы, помимо базисной терапии, получали кудесан (коэнзим Q10) в суточной дозе 60 мг/сут.
Степень эндотелиальной дисфункции (ЭД) определяли методом [33-37] ультразвукового импульсного допплерэхографического исследования плечевой артерии с использованием ультразвукового сканера «Ultramark 9» (линейного датчика с частотой 7Мгц) с оценкой эндотелийзависимой вазодилатации плечевой артерии при манжеточной пробе с расчетом изменения диаметра плечевой артерии (∆d), коэффициента чувствительности эндотелия к напряжению сдвига (K).
Для оценки NO-продуцирующей активности сосудистого эндотелия мы определяли содержание в крови пациентов продуктов деградации NO: нитратов и нитритов с помощью реактивов Nitralyzer™ (World Precision Instruments, Inc. США). Анализ не проводился: пациентам, принимавшим нитропрепараты, при наличии воспалительного процесса любой этиологии и локализации или его купирования менее чем за 7 дней до забора крови, а также в случае нарушения рекомендуемой диеты (из рациона исключались нитратсодержащие продукты: колбасы, свежая зелень, ранние овощи) менее чем за 7 дней до забора крови. Статистическая обработка полученных результатов проводилась на программном комплексе Statistica-6.0, в том числе с использованием критерия χ2.
Результаты исследования и их обсуждение.
При оценке исходного состояния эндотелийзависимой вазодилатирующей способности плечевой артерии у включенных в исследование пациентов было установлено наличие разной степени дисфункции сосудистого эндотелия. В этой связи пациенты были распределены по степени тяжести эндотелиальной дисфункции (табл.1.), которая оценивалась по величине дилатации плечевой артерии в манжеточной пробе [33-37]. При этом большая часть больных имела II степень ЭД, меньшая – I и III степень ЭД, а 0 и IV степени ЭД встречались достаточно редко.
Таблица 1
Распределение больных стабильной стенокардией напряжения в зависимости от степени тяжести эндотелиальной дисфункции по результатам манжеточной пробы до начала лечения.
|
Тяжесть
ЭД
|
Степень дилатации плечевой артерии в манжеточной пробе |
Количество пациентов |
|
|
Основная гр.
|
Контроль
|
||
|
0
|
≥9%
|
3
|
0
|
|
I
|
9%-7,5%
|
19
|
9
|
|
II
|
7,5%-3,0%
|
37
|
14
|
|
III
|
3,0%-2,0%
|
16
|
5
|
|
IV
|
<2,0% или констрикция |
5
|
2
|
В целях удобства статистической обработки и наличия различий в выраженности эндотелиальной дисфункции пациенты, включенные в исследование, как в контрольной, так и в основной группах, были подразделены на две подгруппы: в первую вошли пациенты с I и II ст. ЭД (n1=56 и n2=23 основная и контрольная, соответственно), а во вторую – III и IV ст. ЭД (n1=21 и n2=7).
При анализе изменения параметров дисфункции сосудистого эндотелия (табл.2, рис.1) установлено, что на фоне терапии кудесаном уже к концу 1-го мес. лечения у больных с I-II степенью эндотелиальной дисфункции отмечался достоверный прирост диаметра плечевой артерии (∆D) в пробе с реактивной гиперемией, который составил 18,4% от исходного уровня, что было достоверно выше (p<0,05 по критерию χ2), чем в контрольной группе больных, получавших стандартную терапию, где величина ∆D изменилась незначительно (увеличилась на 6,8% от исходного уровня). В подгруппе больных с выраженной исходной дисфункцией эндотелия (III-IV ст.) величина прироста ∆D была менее значимой и к концу 1-го мес. лечения кудесаном составила 8,3% (табл.2). В контрольной подгруппе с исходно выраженной эндотелиальной дисфункцией достоверных изменений ∆D не отмечалось.
Таблица 2
Изменения скорости кровотока в плечевой артерии (∆V), диаметра плечевой артерии (∆D), напряжения сдвига (τ0,τ2,) и коэффициента чувствительности плечевой артерии к напряжению сдвига (K) в пробе с реактивной гиперемией больных стабильной стенокардией на фоне терапии кудесаном и в контрольной группе, (M±m)
|
Группа
|
Под-группа
|
Показатели
|
Исходно
|
Период лечения
|
|
|
4 нед.
|
8 нед.
|
||||
|
Основная
(прием кудесана)
|
1
I-II ст. ЭД
|
∆V2, (%) |
90,3±11,4
|
76,6±9,5
|
67,5±7,8*
|
|
∆D2, (%) |
7,6±0,25
|
9,0±0,31*
|
10,1±0,3*
|
||
|
τ0, (дин/см2) |
354,5±55,4
|
341,4±45,6
|
342,5±47,1
|
||
|
τ2, (дин/см2) |
597,6±43,1
|
541,4±37,8
|
506,8±29,6*
|
||
|
K, (усл.ед)
|
0,11±0,024
|
0,15±0,014*
|
0,21±0,026*
|
||
|
2
III-IV ст. ЭД
|
∆V2, (%) |
133,1±18,6
|
122,3±17,7
|
107,9±13,4
|
|
|
∆D2, (%) |
2,4±0,22
|
2,6±0,15
|
3,09±0,09*
|
||
|
τ0, (дин/см2) |
378,5±69,7
|
367,1±58,7
|
365,2±57,5
|
||
|
τ2, (дин/см2) |
673,4±62,1
|
641,7±51,3
|
628,9±41,5
|
||
|
K, (усл.ед)
|
0,03±0,005
|
0,035±0,006
|
0,041±0,007*
|
||
|
Контроль-ная
|
1
I-II ст. ЭД
|
∆V2, (%) |
95,8±12,1
|
87,8±8,3
|
98,1±13,3
|
|
∆D2, (%) |
7,4±0,31
|
7,9±0,22
|
8,2±0,15
|
||
|
τ0, (дин/см2) |
357,6±54,2
|
370,8±50,2
|
356,2±53,1
|
||
|
τ2, (дин/см2) |
593,8±42,9
|
571,8±55,0
|
594,7±42,1
|
||
|
K, (усл.ед)
|
0,11±0,015
|
0,14±0,025
|
0,11±0,014
|
||
|
2
III-IV ст. ЭД
|
∆V2, (%) |
141,5±17,3
|
139,5±17,2
|
140,1±17,2
|
|
|
∆D2, (%) |
2,2±0,25
|
2,3±0,3
|
2,38±0,15
|
||
|
τ0, (дин/см2) |
380,2±69,4
|
383,1±71,6
|
385,2±73,3
|
||
|
τ2, (дин/см2) |
684,5±63,4
|
679,9±59,1
|
687,2±68,7
|
||
|
K, (усл.ед)
|
0,027±0,01
|
0,029±0,005
|
0,027±0,006
|
||
Примечание: *-p<0,05 в сравнении с исходным уровнем.
К концу 2 мес. терапии в подгруппе пациентов с I-II ст. эндотелиальной дисфункции, получавших кудесан, прирост ∆D в пробе с реактивной гиперемией составил 32,9% от исходного, что было достоверно выше (p<0,05 по критерию χ2), чем у пациентов в контрольной группе, где ∆D увеличилась на 10,8%. В подгруппе пациентов с исходно выраженной эндотелиальной дисфункцией (III-IV ст.) величина прироста ∆D к концу 2-го мес. терапии кудесаном составила 28,7% (p<0,05 по критерию χ2), а в контрольной подгруппе больных, получавших только базисную терапию, ∆D увеличилась на 8,2% (p<0,05) (табл. 2, рис.1).
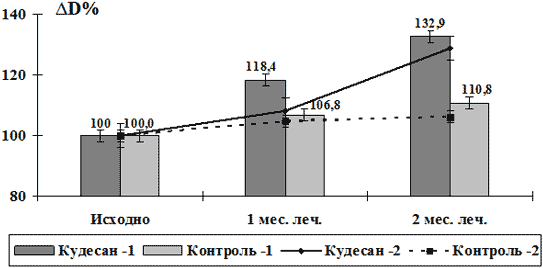
Рис.1. Изменение диаметра плечевой артерии в пробе с реактивной гиперемией больных стабильной стенокардией на фоне терапии кудесаном и в контрольной группе
При оценке степени изменения скорости кровотока в плечевой артерии и величины действия напряжения сдвига на эндотелий, оказалось (табл.2), что изменение показателя ∆Vпроисходило преимущественно за счет уменьшения показателя линейной скорости кровотока в плечевой артерии в пробе с реактивной гиперемей. Регистрируемые до проведения манжеточной пробы изменения кровотока, существенно не отличались от исходных показателей в течение всего периода наблюдения.
К концу 2-го мес. терапии только на фоне применения кудесана наблюдалось снижение ∆V, в тоже время, выраженность этих изменений зависела от исходной степени ЭД. Так, в подгруппе с невыраженной (I-II ст.) ЭД снижение ∆V в плечевой артерии составило 25,2% (p<0,05), у больных с тяжелой ЭД (III–IV ст.) ∆V снизилась на 18,8% (различия между подгруппами достоверны по критерию χ2, p<0,05) (табл.2).
Коэффициент чувствительности плечевой артерии к напряжению сдвига (K) является одним из интегральных показателей, характеризующих эндотелиальную дисфункцию. Уже к концу 1-го месяца терапии в подгруппе пациентов с легкой и умеренной степенью эндотелиальной дисфункции, получавших кудесан, коэффициент чувствительности достоверно увеличился на 38,6% (p<0,05), а к концу курса терапии значение K было на 90,0% выше исходного (p<0,05). В контрольной подгруппе в течение всего периода наблюдения данный параметр не отличался от исходных значений (табл.2, рис.2).
В подгруппах больных с тяжелой степенью нарушения функции эндотелия отмечались менее выраженные изменения коэффициента чувствительности эндотелия к напряжению сдвига (K). В результате проведенной 2-х мес. терапии только в подгруппе пациентов, получавших кудесан, был отмечен достоверный прирост коэффициента чувствительности эндотелия к напряжению сдвига (увеличился на 38,9%, по критерию χ2, p<0,05). В контрольной подгруппе значение K не изменилось (табл.2, рис.2).
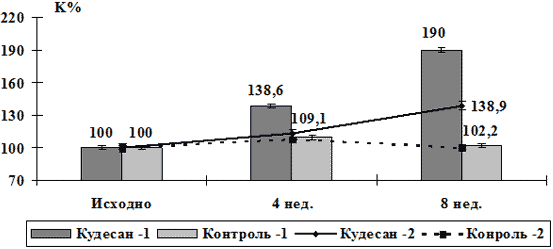
Рис.2. Динамика чувствительности эндотелия плечевой артерии к напряжению сдвига больных стабильной стенокардией напряжения на фоне терапии кудесаном и в контрольной группе.
При анализе изменения содержания нитратов и нитритов в плазме крови больных, как косвенного показателя уровня выработки эндотелием сосудов NO, у пациентов, не применявших нитропрепараты (42 человека в основной группе и 16 человек в группе контроля) установлено, что в сравнении с исходно низкими концентрациями нитратов и нитритов в плазме крови исследуемых групп пациентов отмечено повышение их концентрации на фоне терапии кудесаном и отсутствие изменения их концентрации в группе контроля (табл.3). Полученные данные согласовались с результатами нашего исследования эндотелийзависимой вазодилатации, которые свидетельствовали об увеличении диаметра плечевой артерии и чувствительности эндотелия к напряжению сдвига.
Таблица 3
Содержание нитритов и нитратов в плазме крови больных стабильной стенокардией напряжения на фоне терапии кудесаном, (M±m)
|
Показатель
|
Группа
|
Исходно
|
Период лечения
|
|
|
1мес.
|
2мес.
|
|||
|
Нитраты и нитриты, (мкмоль/л)
|
Основная
|
22,34±0,78
|
26,72±0,91*
|
25,78±0,87
|
|
Контрольная
|
23,51±0,83
|
24,3±0,78
|
24,22±0,67
|
|
Примечание: *-p<0,05
Улучшение эндотелиальной функции под влиянием кудесана, возможно, обусловлено уменьшением перекисной модификации NO, связанное с его прямым антиоксидантным действием, описанным в ряде исследований [7, 8, 21, 28]. Снижение уровня пероксидов в крови уменьшает интенсивность перекисной деградации молекулы NO, что увеличивает продолжительность ее жизни [38], способствуя повышению биодоступности [39].
Иным механизмом реализации эндотелийпротективного воздействия кудесана может служить улучшение внутриклеточного энергообмена эндотелия сосудов, путем стимуляции выработки АТФ в эндотелиоцитах [14, 28, 40, 41], что приводит к увеличению генерации NO, экспрессии NO-синтазы и повышению чувствительности к нему эндотелиальных NO-рецепторов [5, 42].
Таким образом, включение кудесана в комплексную терапию больных стабильной стенокардией позволяет уменьшить проявления дисфункции сосудистого эндотелия, что свидетельствует о перспективности использования препарата с целью вторичной профилактики атеросклероза и ИБС.
1. Применение кудесана (60 мг/сутки) в комплексной терапии больных ИБС, стабильной стенокардией напряжения II-III ФК приводит к увеличению диаметра плечевой артерии и чувствительности эндотелия к напряжению сдвига, а также снижению линейной скорости кровотока в плечевой артерии в пробе с реактивной гиперемией.
2. Эффективность эндотелийпротективного воздействия кудесана у больных стабильной стенокардией напряжения зависит от исходной выраженности эндотелиальной дисфункции.
3. Применение кудесана в комплексной терапии больных ИБС, стабильной стенокардией напряжения II-III ФК способствует улучшению NO-синтезирующей функции эндотелия сосудов, что отражается в увеличении содержания продуктов деградации NO – нитратов и нитритов в плазме крови больных.
1.Беленков Ю.Н., Мареев В.Ю., Агеев Ф.Т. Эндотелиальная дисфункция сердечной недостаточности: возможности терапии ингибиторами АПФ / Ю.Н.Беленков, В.Ю.Мареев, Ф.Т.Агеев // Кардиология. - 2001. - №5. - С.100-104
2. Бувальцев, В.И. Дисфункция эндотелия как новая концепция профилактики и лечения ИБС / В.И. Бувальцев // Международный мед. журнал. - 2001. - № 3. - С.202-208.
3. Scholkens B.A., Unger T. ACE Inhibitors, Endothelial function and Atherosclerosis. Amsterdam Media Medica Publications. March 1993
4. Ulfendahl H.R., Aurell M. Renin–Angiotensin / Portland Press/ London. 1998 p.305
5. Зенков, Н.К. Окислительный стресс. Биохимический и патофизиологические аспекты / Н.К. Зенков, В.З. Ланкин, Е.Б. Меныцикова // М.: МАЙК "Наука/Интерпериодика". – 2001. - 343 с.
6. Климов, А.Н. Липиды, липопротеиды и атеросклероз / А.Н. Климов, Н.Г. Никульчева. – Спб.: Питер, 1995. – 198 с.
7. Ланкин, В.З. Свободнорадикальные процессы при заболеваниях сердечно сосудистой системы / В.З. Ланкин, А.К. Тихазе, Ю.Н. Беленков // Кардиология. - 2000. - № 7. - С. 58-71.
8. Капелько В.И., Рууге Э.К. Исследование действия коэнзима Q10 (убихинона) при ишемии и реперфузии сердца. Применение антиоксидантного препарата кудесан (коэнзим Q 10 с витамином Е) в кардиологии. / В.И. Капелько, Э.К. Рууге // М., 2002. 8–14.
9. Ланкин В.З., Тихазе А.К., Беленков Ю.Н. «Антиоксиданты в комплексной терапии атеросклероза: pro et contra» Кардиология, 2004, 2, 72–81.
10. Захарова И. Н., Обыночная Е. Г., Скоробогатова Е. В., Малашина О. А. Влияние антиоксиданта на основе убихинона на активность перекисного окисления липидов и антиоксидантную защиту при пиелонефрите у детей // Педиатрия. — 2005. — № 4.
11. Аронов Д.М. Применение коэнзима Q10 в кардиологической практике. РМЖ. 2004, Т 12, №15, 905 – 909.
12. Капелько В.И. Активные формы кислорода, антиоксиданты и профилактика заболеваний сердца. РМЖ. 2003, Т.11, № 21, 1185 –1188.
13. Чапидзе ГЭ, Капанадзе СД, Долидзе НК, Лацабидзе НЭ, Бахуташвили ЗВ. Комбинированная терапия антиоксидантом коэнзимом Q10 и симвастатином больных коронарным атеросклерозом. Кардиология, 2006, 8, 11-13.
14. Мингазетдинов, Л.Н. Роль перекисей липидов и гемореологических расстройств в патогенезе и клиническом течении ИБС / Л.Н. Мингазетдинов, A.M. Закирова, В.З. Ланкин // Терапевт, арх. - 1993. - № 8. - С. 12-15.
15. Ключников С. О., Гнетнева Е. С. Убихинон. Теория и клиническая практика // Педиатрия им. Сперанского. — 2008. — № 3.
16. Лакомкин В.Л., Коркина О.В. и соавт. «Защитное действие убихинона (коэнзима Q10) при ишемии и реперфузии сердца» Кардиология, 2002, 12, 51–55.2.
17. Кухарчук В. В. Современные подходы к терапии и профилактике атеросклероза. Врач 2005; 4: 15—17.
18. Кравцова Л. А., Березницкая В. В., Школьникова М. А. Применение коэнзима Q10 в кардиологической практике // Российский вестник перинатологии и педиатрии. — 2007. — Т. 52. — № 6. — С. 51-58.
19. Ланкин В. З., Капелько В. И., Руге Э. К., Тихазе А. К., Беленков Ю. Н. Коэнзим Q10: физиологическая функция и перспективы использования в комплексной терапии заболеваний сердечно-сосудистой системы. Пособие для врачей. — М.: Медпрактика-М. – 2008. – С. 22.
20. Ланкин B.3., Тихазе А.К., Каминная В.И. Интенсификация in vivo свободнорадикального окисления липопротеидов низкой плотности в плазме крови больных ИБС при терапии ингибитором ГМГ-КоА-редуктазы правастатином и подавление липопероксидации убихиноном Q10. / B.3. Ланкин, А.К. Тихазе, В.И. Каминная и др. // Бюлл. экспер. и мед. биол. – 2000. - № 129. – С. 176-179.
21. Побежимова, Т.П. Биохимические и физиологические аспекты функционирования убихинона / Т.П. Побежимова, В.К. Войников // Биологические мембраны. – 1999. – Т. 16. - № 5. – С. 485-489.
22. Коровина Н.А., Рууге Э.К. Использование коэнзима Q10 в профилактике и лечении. Применение антиоксидантного препарата кудесан (коэнзим Q10 с витамином Е) в кардиологии. М.,2002, 3–7.
23. Каленикова Е.И., Городецкая Е.А., Медведев О.С. Фармакокинетика коэнзима Q10 // Бюллетень экспериментальной биологии и медицины. – 2008. – Т. 146. – № 9
24. Аронов Д.М. Что важно знать практическому врачу об убихиноне (коэнзиме Q10) // Человек и лекарство. 2006. Т. 14. № 4. С. 223—229.
25. Singh RB, Kartikey K, Charu AS, Niaz MA, Schaffer S. Effect of taurine and coenzyme Q10 in patients with acute myocardial infarction // Adv Exp Med Biol. – 2003. – № 526. – Р .41–48.
26. Kuklinski B, Weissenbacher E, Fähnrich A. Coenzyme Q10 and antioxidants in acute myocardial infarction//Mol Aspects Med. – 1994. – № 15. – Р. 143–147.
27. Tiano L, Belardinelli R, Carnevali P, Principi F, Seddaiu G, Littarru GP. Effect of coenzyme Q10 administration on endothelial function and extracellular superoxide dismutase in patients with ischaemic heart disease: a double-blind, randomized controlled study // Еur Heart J. – 2007. – Sep. № 28(18). – Р. 2249–2255.
28. Крылов, В.Н. Влияние убихинона-10 на энергетический обмен и пол в миокарде крыс при ишемии / В.Н. Крылов, Л.Д. Лукьянова, А.С. Корягин, Е.В. Ястребова // Бюлл. эксперим. биолог. и мед. - 2000. – Т. 130.- № 7 . – С.35-38.
29. Черноморцева Е.С., Клявс Ю.П., Дёмин А.В., Литвякова Е.И., Литвякова М.И. Возможность фармакологической коррекции эндотелиальной дисфункции макродидами на модели реактивного вакулита // Материалы 74-й межвузовской итоговой научной конференции студентов и молодых ученых: Молодежная наука и современность. – 2009. – Т2. – С. 122.
30. Покровский М.В., Кочкаров В.И., Покровская Т.Г. Методические подходы для количественной оценки развития эндотелиальной дисфункции при L-NAME-индуцированной модели дефицита оксида азота в эксперименте // Рос. жур. иммунологии. – 2006. – Т. 96. – С. 60-61.
31. Цепелев В.Ю., Демьянов А.В., Маяков А.И., Цыбульский И.В. Патогенетическая коррекция эндотелиальной дисфункции ацетилсалициловой кислотой. Материалы 74-й межвузовской итоговой научной конференции студентов и молодых ученых: Молодежная наука и современность. – 2009. – Т2. – С. 223.
32. Покровский М.В., Кочкаров В.И., Покровская Т.Г. Новый взгляд на коррекцию эндотелиальной дисфункции // Российский журнал иммунологии. 2006. Т. 9. - С. 60-61.
33. Иванова, О.В. Определение чувствительности плечевой артерии к напряжению сдвига на эндотелии как метод оценки состояния эндотелийзависимой вазодилатации с помощью ультразвука высокого разрешения у больных с артериальной гипертензией / О.В. Иванова, А.Н. Рогозова, Т.В. Балахонова // Кардиология. – 1998. - Т.38. - № 3 - С.37-41.
34. Джурич Д., Стефанович Е., Тасич Н. Применение тестов реактивности плечевой артерии при оценке дисфункции эндотелия в процессе старения. Кардиология 2000; 11: 24–7.
35. Затейщиков Д.А., Минушкина Л.О., Кудряшова О.Ю. Функциональное состояние эндотелия у больных артериальной гипертензией и ишемической болезнью сердца. Кардиология 2000; 6.
36. Celermajer DS. Endothelial dysfunction: does it matter? Is it reversible? J Am Coll Cardiol 1997; 30 (3): 325–33.
37. Celermajer DS, Sorensen KE, Gooch VM et al. Non–invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis. Lancet 1992; 340 (8828): 1111–5.
38. Зотова, И.В. Синтез оксида азота и развитие атерогенеза / Н.В. Зотова, Д.А. Затейщиков, Б.А. Сидоренко // Кардиология. - 2002. - № 4. - С. 58-67.
39. Kastle, T. Potentiation of nitric oxide mediated vascular relacsation by sc52608 superoxide dismutase mimic / T. Kastle, S. Settle, T. Mako // Proc. Soc. Exp. Biol. Med. – 1995. – Vol. 208. – P. 170-177.
40. Дюмаев, К.М. Антиоксиданты в профилактике и терапии патологий ЦМС // К.М. Дюмаев, Т.А. Воронина, Л.Д. Смирнов. – М., 1995. – 271 с.
41. Лукьянова, Л.Д. Молекулярные механизмы и регуляция энергетического обмена / Л.Д.Лукьянова // Бюлл. эксперим. и мед. биол. – Пущино. – 1997. – Т. 124. – С. 224-254.
42. Huertas J. R., Martinez- Velasco E., Ibanez S. et al. Virgin olive oil and coenzyme Q10 protect heart mitochondria from peroxidalive damage during aging. Biofactors 1999:9:337-343.
ПОЖАЛУЙСТА, ОСТАВЬТЕ ВАШЕ МНЕНИЕ О СТАТЬЕ В КОММЕНТАРИЯХ
АптекиБольницыСкорая медицинская помощьПоликлиники |
ДиспансерыАкушерство и Гинекология |
Медицинские центрыСервис онлайн записи к врачу |
